Приготовление щелочного электролита — Справочник химика 21
При приготовлении и хранении электролита его предохраняют от доступа воздуха, чтобы предотвратить поглощение углекислоты, так как она увеличивает саморазряд аккумуляторов и снижает емкость. При содержании в электролите до 50 г/л соды или поташа электролит заливать не рекомендуется. Все остальные неисправности, возникшие при эксплуатации (утечка тока, короткое замыкание, механические повреждения и т. п.), устраняют обычным способом. Для стабилизации емкости щелочные аккумуляторы подвергают двум-трем тренировочным циклам нормальных режимов. В отдельных случаях, когда батарея на третьем разряде отдает менее 80% номинальной емкости, следует провести дополнительно 1—2 цикла. В первые два цикла батарею заряжают током 150 А в течение [c.264]Кроме того, щелочной электролит может быть приготовлен электрохимическим способом. [c.

Щелочной электролит готовится путем растворения солей в чистой воде или конденсате. При приготовлении из двуххлористого олова вначале получается осадок 5п (ОН)2, который [c.175]
Элемент собран в пластмассовом корпусе. Нижняя часть корпуса заполнена активной массой отрицательного электрода, представляющей собой амальгамированный цинковый порошок, смешанный с загустителем. Последний содержит щелочной электролит и крахмал. Над цинковым электродом расположена пастовая диафрагма, состоящая из щелочного электролита, загущенного крахмалом и пшеничной мукой. При изменении влажности воздуха такая паста не должна ни высыхать, ни намокать. При намокании пасты раствор будет проникать в поры положительного электрода, снижая его работоспособность. Электролит, используемый для приготовления пасты, представляет собой концентрированный раствор едкого кали, насыщенный окисью цинка и содержащий небольшое количество хромовых солей.
Для приготовления щелочного электролита следует налить в сосуд дистиллированную воду и доливать щелочь небольшими порциями, тщательно перемешивая электролит железной или стеклянной палочкой. Флакон со ще.ючью следует открывать осторожно, не применяя больших усилий. Перед тем как открыть флакон, пробка которого залита парафином, следует предварительно прогреть горло флакона теплыми тряпками.
Флакон со ще.ючью следует открывать осторожно, не применяя больших усилий. Перед тем как открыть флакон, пробка которого залита парафином, следует предварительно прогреть горло флакона теплыми тряпками.
Электролитическое рафинирование. Электролитическое рафинирование галлия ведется из щелочного электролита электролиз в кислой среде дает меньший выход по току. Анодом служит расплавленный галлий, к которому подводится постоянный ток с помощью платинового контакта. Катодом служит либо нержавеющая сталь, либо расплавленный галлий, уже прошедший электролитическое рафинирование. Для приготовления электролита готовится 15—20%-ный раствор чистейшего едкого натра в дважды дистиллированной воде. Для изготовления самой ванны наиболее подходящим материалом являются полимеры, например винипласт, так как кварц и стекло разрушаются щелочью и вносят примеси в электролит. Электролиз ведется при температуре 60° С. Напряжение на ванне 6 в, катодная и анодная плотность тока 0,1—0,3 а см , выход по току 90%.
Прн приготовлении электролита, как кислотного, так и щелочного, имеет место разогревание. Наливать в аккумуляторы горячий электролит нельзя, надо дать ему остыть до комнатной температуры. В аккумулятор наливают электролит через воронку в таком количестве, чтобы уровень раствора был по крайней мере на 10—12 мм выще пластин. О высоте этого уровня можно судить, опуская в отверстие для пробки узкую стеклянную трубку. Закрыв верхний конец трубки пальцем, трубку осторожно вынимают и отмечают высоту уровня жидкости в ней. Затем отверстие в крышке аккумулятора плотно закрывают.
Корректируют щелочные оловянные электролиты в основном оловом и едким натром (в соответствии с данными анализа), которые рекомендуется вводить как можно чаще, небольшими порциями. Олово добавляется в виде отдельно приготовленного раствора станната натрия. Количество свободной щелочи, вводимой в электролит вместе с оловом, должно соответствовать содержанию свободной щелочи в электролите.
Электролитический способ снятия олова с жестяных отходов получил наиболее широкое применение, особенно в небольших установках при консервных заводах для переработки обрезков белой жести (до 30% производства банок). В кислых растворах железо на аноде растворяется вместе с оловом этого можно почти полностью избежать, если ввести в раствор серной кислоты сильный окислитель, например, хромовый ангидрид, тогда можно получать довольно чистое олово иа катоде с плотностью тока до 1000 а м однако кислый электролит требует частой корректировки, приготовление его сложно, аппаратура должна быть кислотостойкой. Повсеместное применение получили щелочные электролиты, позволяющие анодно растворять только олово и пассивировать железо.
Для приготовления солей Os целесообразно использовать электролиз. Осмий довольно легко переходит в раствор при анодной обработке в щелочной среде с выходом по току 45—50 %. По данным [134], при анодном растворении осмия в 5 и. КОН выход металла по току при плотности тока 1—5 А/дм достигает 96— 98 %, считая на восьмивалентные ионы металла. В электролите, содержащем 4—20 г/л соли осмия (в пересчете на металл) и 10—50 г/л КОН, получены блестящие, хорошо сцепленные с основой осадки толщиной 0,3—0,5 мкм. Несколько большей толщины покрытия осаждали из хлоридного электролита состава (г/л)
Осмий довольно легко переходит в раствор при анодной обработке в щелочной среде с выходом по току 45—50 %. По данным [134], при анодном растворении осмия в 5 и. КОН выход металла по току при плотности тока 1—5 А/дм достигает 96— 98 %, считая на восьмивалентные ионы металла. В электролите, содержащем 4—20 г/л соли осмия (в пересчете на металл) и 10—50 г/л КОН, получены блестящие, хорошо сцепленные с основой осадки толщиной 0,3—0,5 мкм. Несколько большей толщины покрытия осаждали из хлоридного электролита состава (г/л)
После выдержки в течение 10—12 ч смесь отстаивается, образовавшийся верхний слой водного раствора сливается, а оставшееся сульфированное масло нейтрализуется раствором каустической соды до щелочной реакции и вводится в электролит для кадмирования. Приготовленный электролит подвергают анализу и по его данным корректируют, добавляя необходимые количества цианистого натрия, сульфата натрия, окиси кадмия. [c.60]
Однако большая часть осадков заметно растворяется в электролите.
Приготовление электролита производится в посуде, химически устойчивой к щелочам. Обычно для этой цели применяются ви-нипластовые баки. Стеклянная посуда нежелательна, так как соединения кремния переходят из стекла в щелочные растворы в виде силиката калия, изменяя общее содержание соединений кремния в растворе. Силикат калия влияет на скорость кристаллизации окиси цинка из пересыщенного цинкатного раствора при разряде элемента малыми плоскостями тока, предотвращая появление внутренних замыканий. Однако силикат калия снижает стабильность э. д. с. и напряжения ртутно-цинковых элементов, поэтому его присутствие недопустимо в электролите ЭЩ-28.
Силикат калия влияет на скорость кристаллизации окиси цинка из пересыщенного цинкатного раствора при разряде элемента малыми плоскостями тока, предотвращая появление внутренних замыканий. Однако силикат калия снижает стабильность э. д. с. и напряжения ртутно-цинковых элементов, поэтому его присутствие недопустимо в электролите ЭЩ-28.
Конструкция серебряно-цинковых аккумуляторов существенно отличается от конструкции обычных щелочных или кислотных аккумуляторов. В серебряно-цинковых аккумуляторах положительные пластины изготовляются из чистого, тем или иным способом приготовленного серебра, а отрицательные— из окиси цинка в смеси с порошком металлического цинка. Положительные пластины отделены от отрицательных несколькими слоями гидратцеллюлозной пленки, применение которой обусловлено тем, что через нее, с одной стороны, хорошо диффундирует электролит, а с другой стороны, она препятствует миграции коллоидных частиц окислов серебра от положительного электрода к отрицательному и про-  143]
143]
С целью снижения скорости коррозии цинка в щелочном электролите цинк амальгамируется ртутью путем добавления к цинковому порошку желтой окиси ртути. Приготовление смеси этих компонентов проводится в лопастных смесителях, футерованных некорродирующими и пеамальгамирующимися материалами. В работающий смеситель с помощью дозирующего устройства засыпают цинковый порошок и окись ртути в количестве 17о от веса цинка. Сухое перемешивание компонентов длится 15—20 мин. Затем в смеситель заливают щелочной эле.ктролит. Для предотвращения бурного растворения цинка температура электролита не должна превышать 15° С.
Отрицательный электрод — пастированный, с развитой границей раздела цинк — электролит, что исключает пассивацию электрода. Паста содержит цинковый порошок, ингибитор коррозии (желтый оксид ртути, около 1% к массе цинка), щелочной электролит и загуститель (крахмал, карбоксиметилцеллю-лозу и т. п.). Оксид ртути амальгамирует цинковый порошок, что увеличивает перенапряжение выделения водорода на цинке. Электролит, используемый для приготовления пасты, содержит 680—760 кг/м КОН и 40—60 кг/м 2пО. [c.71]
Электролит, используемый для приготовления пасты, содержит 680—760 кг/м КОН и 40—60 кг/м 2пО. [c.71]
В качестве электролита в ртутно-цинковых элементах используется щелочной калиевый электролит плотностью 1,40, насыщенный окисью цинка. Электролит в основном заключен в порах электродов и сепараторной бумаги. В некоторых ртутно-цинковых элементах используется загущенный электролит, приготовленный добавкой к электролиту 1,5—4% карбоксилметилцел-люлозы. [c.286]
Смесь перемешивается до загустевания, после чего при непре-кращающемся перемешивании в нее вводится остальное количество масла тремя порциями. Полученный продукт легко эмульгирует с образованием стабильной эмульсии молочно-белого цвета, не расслаивающейся при длительном хранении. Паста при хранении выделяет некоторое количество масла, легко замешивающегося. Однако при получении эмульсии выделяется некоторое количество масла, вследствие чего хранение пасты не рекомендуется. Эмульсию из нее следует приготовлять в день приготовления пасты, при этом необходимо вводить, как это обычно принято, щелочной электролит. [c.108]
[c.108]
Когда электролит становится щелочным, маслянистое вещество, всплывающее наверх, удаляют при помощи пипетки (примечание 8). Это масло промывают равным объемом 10%-ного раствора поташа (примечание 9), затем равным объемом 3,5%-ной соляной кислоты и, наконец, два раза водой, каждый раз половинным объемом. (Если на этой стадии образуется эмульсия, то ее с успехом можно разрушить добавлением небольшого количества эфира.) Полученное вещество криста.плизуют из метилового спирта, фильтруют с отсасыванием и дважды промывают на фильтре охлажденным до 0° метиловым спиртом (примечание 10). Белоснежный н воскообразный по внешнему виду препарат сушат в эксикаторе над серной кислотой. Выход вещества с т. пл. 41—42° составляет 16— 22 г (40—55% теоретич.). Приведенные данные, касающиеся процентного выхода, рассчитаны, однако, исходя только из 50 г кислого этилового эфира себациновой кислоты, израсходованного во второй части синтеза использованные на приготовление начального электролита 86,5 г его во внимание не принимаются. Поэтому приведенный синтез целесообразно проводить лишь в том случае, если надо поставить несколько последовательных опытов (примечание 8). [c.509]
Поэтому приведенный синтез целесообразно проводить лишь в том случае, если надо поставить несколько последовательных опытов (примечание 8). [c.509]
При приготовлении гипогалогенитов для проведения реакций замещения применяют электроды из гладкой платины в электролите, содержащем гало-генид щелочного или щелочноземельного металла. Галоген образуется на аноде, а водород—на катоде. От анода галоген диффундирует по направлению к катоду, встречает при этом щелочь, получающуюся на катоде, и образует с ней гииогалогенит, который и реагирует с органическим соединением. При использовании галогенидов натрия или калия необходимо поддерживать раствор нейтральным, вводя в него либо двуокись углерода, либо йод в случае, если в качестве электролита используют раствор йодида. Последний восстанавливается до йодистоводородной кислоты, которая нейтрализует щелочь. Другой метод включает применение вспомогательного катода в пористом сосуде. Таким образом не вся щелочь образуется на главном катоде. [c.349]
[c.349]
Одними из лучших растворителей окислов металлов являются фториды, а также некоторые другие более сложные двойные соли, содержащие фториды щелочных и многовалентных металлов, В настоящей работе впервые для электролитического разложения с целью выделения диборида циркония применен фтороборатно-фто-роцирконатный электролит, содержащий окислы бора и циркония. Для его приготовления в качестве исходного цирконийсодержащего сырья применялась двуокись циркония. [c.329]
НОСТИ воспользоваться радиоактивными изотопами кислорода, имеющими очень малый период полураспада. Поэтому в качестве объекта исследования были избраны сульфидные пленки. Известно, что предварительная обработка золота в водноспиртовом растворе сульфидов щелочных металлов обеспечивает прочное сращивание с ним электролитических осадков меди. Перед измерением золотые пластинки погружались на 20 сек. в водноспиртовый раствор сернистого натрия, приготовленного из серы, содержавшей радиоактивный изотоп 8 , промывались водой и просушивались, после чего регистрировалась радиоактивность образца. Подсчет импульсов, отнесенный к 1 см поверхности, показал 96 имп/мин. Затем на указанную пластинку в течение 10 сек. осаждалась медь в кислом электролите. После электролиза радиоактивность образца заметно уменьшилась, составив 38 имп/мин см — это говорит о ч астичном удалении пленки. [c.515]
Подсчет импульсов, отнесенный к 1 см поверхности, показал 96 имп/мин. Затем на указанную пластинку в течение 10 сек. осаждалась медь в кислом электролите. После электролиза радиоактивность образца заметно уменьшилась, составив 38 имп/мин см — это говорит о ч астичном удалении пленки. [c.515]
Что заливать в щелочной аккумулятор
Щелочные аккумуляторы широко распространены и довольно востребованы в настоящее время. Их применяют в различных производственных сферах: на железной дороге, в горнодобывающей отрасли, а также в бытовых целях. Такие АКБ зарекомендовали себя, как надежные и долговечные устройства. При правильной эксплуатации срок их службы составляет от пяти до десяти лет. Для этого следует своевременно проводить техобслуживание аккумуляторов: предупреждать возможность возникновения короткого замыкания внутри банок, вовремя замерять плотность электролита и доливать его при необходимости. И здесь возникает вопрос: что заливать в щелочной аккумулятор? В данной статье рассмотрим, каким электролитом заправляют такие устройства, какие его виды существуют, а также как правильно самостоятельно приготовить раствор для щелочных аккумуляторов.
Виды раствора для щелочных АКБ
Существует два типа щелочных АКБ: никель-кадмиевые и никель-железные. Для таких батарей применяют электролиты, имеющие натриевый или калиевый состав. По сути, электролит для щелочных батарей представляет собой водный раствор гидроксида калия или гидроксида натрия. Зачастую к раствору добавляют еще и однопроцентный гидроксид лития, что в значительной степени повышает емкость аккумуляторов и увеличивает их срок службы.| Готовый электролит | Диапазон рабочей температуры, градусы Цельсия | Плотность, г/см3 |
|---|---|---|
| Калиевый | от -20 до +35 | от 1,19 до 1,21 |
| Калиево-литиевый | от -20 и ниже | от 1,26 до 1,28 |
| Натриево-литиевый | от +5 до +40 | от 1,18 до 1,20 |
 А можно и приготовить собственными силами в домашних условиях.
А можно и приготовить собственными силами в домашних условиях.Самостоятельное приготовление электролита
При самостоятельном приготовлении электролита для щелочных АКБ важно помнить о том, что калиево-литиевые и натриево-литиевые растворы взаимозаменяемы, но совмещать их ни в коем случае нельзя. Далее детально рассмотрим весь процесс приготовления калиево-литиевого электролита.Что понадобиться для раствора
Для приготовления щелочного электролита понадобится:- дистиллированная вода, имеющая ГОСТ 6709-72;
- гидроксид калия (едкий калий) марки А (твердый) или В (жидкий), имеющий ГОСТ 9285-69;
- гидроксид лития, имеющий ГОСТ 8595-75;
- чистая железная, чугунная или пластмассовая посуда.

Процесс приготовления
При приготовлении электролита необходимо строго соблюдать технологию и последовательность действий:- Налить нужное количество дистиллированной воды в термостойкую посуду из расчета 3 л. на 1 кг твердого гидроксида калия и гидроксида лития.
- Опускаем щелочь (KOH и LiOH в соотношении 0,04/0,045) в воду маленькими частями, используя для этого стальные щипцы.
- Растворить щелочь в воде, помешивая раствор стеклянной, эбонитовой или стальной мешалкой, что существенно ускорит время реакции.
- Остудить полученный раствор и настоять его в течение трех-шести часов, плотно закрыв крышкой, до полного оседания примесей.
- По прошествии вышеуказанного времени, аккуратно слить получившуюся прозрачную жидкость и замерить ареометром плотность.

Проверка плотности
Для полной готовности электролита нужно добиться требуемой его плотности. В ее измерении поможет ареометр. Необходимо понимать, что плотность раствора выбирается в зависимости от температуры окружающей среды. Летом, к примеру, ее нужно снижать, а зимой – наоборот, повышать, ведь чем выше плотность, тем больше срок службы устройства. Оптимальной плотностью для жаркого времени считается – от 1,21 до 1,23 г/см3, в зимний период она должна составлять от 1,27 до 1,29 г/см3. Чтобы изменить плотность полученного раствора необходимо добавлять в него либо щелочь, что сделает его более плотным, либо дистиллированную воду, что уменьшит первоначальный результат.Чтобы проверить плотность щелочного электролита необходимо соблюдать следующие правила:
- Производить замеры во всех емкостях аккумулятора.
- Не измерять плотность сразу после залива жидкости в АКБ.
- Более точные показания можно получить при температуре электролита не выше комнатной.

- В обязательном порядке промыть измерительный прибор после использования.
Хранение
Хранить приготовленный электролит необходимо в стеклянных емкостях, герметично закрытых резиновыми пробками и залитых парафином. На них следует приклеить ярлыки, где нужно указать состав содержимого, его плотность и дату изготовления.Меры предосторожности
При изготовлении раствора для заливки в щелочные АКБ следует соблюдать меры предосторожности при работе с едкими химическими веществами, так как щелочь – довольно опасный элемент и, попав на кожу или слизистые оболочки, может вызвать сильные химические ожоги. Поэтому при работе с ней нужно использовать средства индивидуальной защиты: перчатки, очки. Необходимо также следить за тем, чтобы раствор не попал на одежду или незащищенные участки тела.Меднение в домашних условиях
Медь – это один из древних металлов: люди начали применять ее для создания орудий труда еще в 4 тысячелетии до нашей эры. Такое широкое распространение меди объяснимо тем, что вещество встречается в природе в металлическом самородном состоянии. И сегодня медь используется повсеместно – в металлургии, автомобильной промышленности, электротехнике и строительстве.
И сегодня медь используется повсеместно – в металлургии, автомобильной промышленности, электротехнике и строительстве.
Металлическая медь представляет собой тяжелый металл розово-красного цвета, ковкий и мягкий, который плавится при температуре больше 1080 градусов по Цельсию, очень хорошо проводит теплоту и электрический ток: электропроводимость меди выше в 1,7 раза, чем алюминия и больше в 6 раз выше, чем железа, и только немного уступает электропроводимости серебра.
Специфические особенности меди определяются содержанием в металле конкретных примесей, количество которых может различаться приблизительно в 10 – 50 раз. По содержанию кислорода принято использовать следующую классификацию меди:
бескислородная медь с содержанием кислорода меньше 0,001%;
медь рафинированная с содержанием кислорода от 0,001до 0,01%, но с увеличенным присутствием фосфора;
медь большой чистоты с содержанием кислорода примерно 0,03-0,05%;
металл общего назначения с содержанием кислорода 0,05 – 0,08%.
В меди кроме кислорода может присутствовать водород, который в металл попадает в процессе электролиза или при совершении отжига в атмосфере, которая содержит водяной пар. При высокой температуре водяной пар разлагается с формированием водорода, который в медь легко диффундирует.
Атомы водорода в бескислородной меди размещаются в междоузлиях кристаллической решетки и на свойствах металла особо не сказываются. В кислородсодержащей меди водород способен взаимодействовать при высоких температурах с закисью меди, при этом образуется в толще меди водяной пар, которому присуще высокое давление, что приводит к вздутиям, трещинам и разрывам. Это явление носит название «водородная болезнь».
Железо, висмут, сурьма и свинец ухудшают пластичность меди. Примеси, что являются малорастворимыми в меди (свинец, кислород, сера, висмут), провоцируют хрупкость при высокой температуре, что затрудняет процесс горячей обработки давлением.
Физические свойства меди
Основное свойство меди, определяемое её использование, — высокая электропроводность или малое удельное электрическое сопротивление. Подобные примеси как железо, фосфор, мышьяк, олово и сурьма, значительно ухудшают её электрическую проводность. На величину электропроводности оказывает большое влияние механическое состояние меди.
Подобные примеси как железо, фосфор, мышьяк, олово и сурьма, значительно ухудшают её электрическую проводность. На величину электропроводности оказывает большое влияние механическое состояние меди.
Второе важное свойство меди – значительная теплопроводность. Легирующие добавки и свойства уменьшают теплопроводность меди, поэтому созданные на медной основе сплавы самой меди значительно уступают по этому показателю.
Медь при нормальных температурах является коррозиционно устойчивой в таких средах, как пресная вода, сухой воздух, морская вода при небольшой скорости движения воды, неокислительные кислоты и растворы соли при отсутствии кислорода, сухие галогенные газы, щелочные растворы за исключением солей аммония и аммиака, органические кислоты, фенольные смолы и спирты.
В аммиаке, хлористом аммонию, окислительных минеральных кислотах и растворах кислых солей медь не устойчива. Её коррозионные свойства также заметно ухудшаются в некоторых средах с возрастанием количества примесей.:format(png)/afd1188a4ff4360.s.siteapi.org/img/osyx49977ogg4s40sgc0ck44gckwg0) Допускается контакт меди с её сплавами, с оловом, свинцом во влажной атмосфере, морской и пресной воде. В то же время контакт меди с цинком и алюминием не допускается вследствие их быстрого разрушения.
Допускается контакт меди с её сплавами, с оловом, свинцом во влажной атмосфере, морской и пресной воде. В то же время контакт меди с цинком и алюминием не допускается вследствие их быстрого разрушения.
Медь, ее сплавы и соединения нашли широкое применение в разных отраслях промышленности. Медь в электротехнике используют в чистом виде в производстве шин контактного и голого проводов, кабельных изделий, электрогенераторов, телефонного оборудования и радиоаппаратуры. Из меди изготавливают вакуум-аппараты, теплообменники и трубопроводы.
Сплавы меди с различными металлами используют в автомобильной промышленности и для изготовления химических аппаратов. Проволока из красной меди изготовления всевозможных шнуров и выгибания самых сложных элементов. Высокие свойства меди делают ее незаменимой при производстве филигранных деталей.
Процедура меднения
Меднением называют процедуру гальванического нанесения меди, толщина слоя которой составляет 1 — 300 мкм и больше. Меднение стали является одним из важнейших процессов в гальванике, что применяется в качестве предварительного процесса при подготовке металлической поверхности для покрытия другими металлами – при хромировании, никелировании и покрытии серебром, а также как законченный самостоятельный процесс.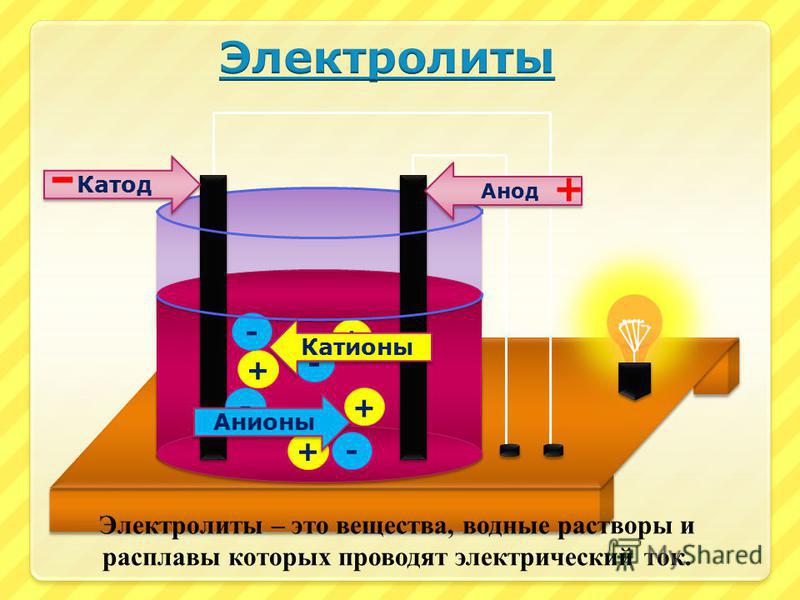
Использование меднения как подготовительной манипуляции связано с тем, что этот металл способен очень прочно держатся на стали, выравнивать дефекты поверхности. Другие материалы на медь хорошо осаждаются, а вот на чистую сталь – не очень.
Медные покрытия характеризуются высоким сцеплением с разными металлами, высокой электропроводностью и пластичностью. Их принято наносить на стальные, цинковые и алюминиевые детали.
Только что нанесённое покрытие меди имеет ярко-розовый матовый или блестящий цвет, зависимо от технологии нанесения. Медные покрытия в атмосферных условиях способны легко окисляться и покрываться налетом окислов, приобретая пятна различных оттенков и радужные разводы.
Использование меднения
В большинстве своем гальваническое меднение металлов используют в таких случаях:
В декоративных целях. Огромной популярностью в настоящее время пользуются старинные изделия из меди. Процедура меднения позволяет наносить на металл медные покрытия, которые как бы «состариваются» после специальной обработки и выглядят так, будто изготовлены давным-давно.
В гальванопластике. Используется гальваническое меднение железа для создания металлических копий изделий разной формы и различных размеров. Создаётся пластиковая или восковая основа, которую покрывают электропроводящим лаком и слоем меди. Подобную технологию меднения часто используют при изготовлении ювелирных изделий, сувениров, барельефов, матриц и волноводов.
В технических целях. Меднение металла большое значение имеет в электротехнической области. Благодаря низкой стоимости меднения по сравнению с покрытиями золотом или серебром, медные покрытия нашли применение при изготовлении электротехнических шин, электродов, контактов и прочих элементов, которые работают под напряжением. Меднение зачастую используется как покрытие под пайку.
Меднение применяется в сочетании с прочими гальваническими покрытиями:
При нанесении многослойного защитно-декоративного покрытия. Как правило, медь используется в сочетании с хромом и никелем (3-слойное защитно-декоративное покрытие) и прочими металлами как промежуточный слой для увеличения сцепления с основным металлом и получения более прочного и блестящего покрытия.
Для предохранения участка при цементации. Меднение свинца способно предохранять участки стальных изделий от цементации — науглероживания. Покрывают медью исключительно те участки, которые подлежат в будущем обработке резанием. Твёрдый науглероженный поверхностный слой не поддается подобным обработкам, а медь может защитить покрытые участки от процесса диффузии углерода в них.
При восстановлении и ремонте деталей. Меднение металла является важной процедурой при работах реставрационного характера и восстановлении хромированных частей мотто- и автомобильной техники. Наносить принято значительный слой меди – порядка 100-250 мкм и больше, который закрывает дефекты металла и поры и выполняет функции новой основы для последующих покрытий.
Виды меднения
Процедура меднения своими руками доступна для выполнения даже новичками. Для этого достаточно только знать её основные тонкости. Существует два способа меднения в домашних условиях: с погружением в электролит и без погружения.
С погружением в электролит
Металлическое изделие обрабатывают наждачной бумагой для удаления оксидной пленки, протирают щеткой, промывают как следует водой, обезжиривают в горячем содовом растворе и промывают еще один раз. После этого принято опускать в стакан или банку на медных проволочках две медные пластинки, которые являются анодами.
Между пластинками подвешивают на проволочке деталь. Проволочки, идущие от медных пластинок, соединяют вместе и подключают к плюсу источника тока, а деталь – к минусу. После этого в цепь включается реостат для регулировки тока и миллиамперметр. Необходим источник постоянного тока, который имеет напряжение не больше 6 В.
Для меднения дома нужно приготовить следующий раствор электролита. Возьмите 20 грамм медного купороса и 2-3 миллилитра серной кислоты на 100 миллилитров воды и налейте в посуду. Следите, чтобы данный раствор полностью покрыл электроды.
При использовании реостата нужно установить ток в пределах 10 — 15 мА на каждый сантиметр квадратный поверхности детали. Где-то через 20 минут следует выключить ток и вынуть изделие, оно уже покрылось тонким медным слоем. Чем дольше будет идти процесс, тем слой меди получится толще.
Где-то через 20 минут следует выключить ток и вынуть изделие, оно уже покрылось тонким медным слоем. Чем дольше будет идти процесс, тем слой меди получится толще.
Без погружения в электролит
Данную процедуру проводят для стали, алюминия и цинка. С одного конца многожильного провода снимают изоляцию, затем необходимо растеребить тонкие медные проволочки для получения медной кисти. Для удобства работы необходимо привязать ее к медной кисти или деревянной палочке, а другой конец кабеля нужно подсоединить к плюсу источника тока.
Дальше следует приготовить электролит — раствор медного купороса, лучше слегка подкисленный, и налить в широкую склянку, в которую кисть будет удобно макать. Подготовьте металлическую пластинку или какой-то другой маленький предмет с плоской поверхностью. Его нужно протереть с помощью мелкой наждачной шкурки и обезжирить посредством кипячения в растворе стиральной соды.
Затем необходимо положить пластинку в кювету или ванночку и подсоединить ее с помощью провода к минусу источника тока. После того, как схема собрана, вам следует только ввести электролит. Обмакните в раствор медного купороса «кисть», которой следует провести вдоль пластинки, не дотрагиваться до поверхности.
После того, как схема собрана, вам следует только ввести электролит. Обмакните в раствор медного купороса «кисть», которой следует провести вдоль пластинки, не дотрагиваться до поверхности.
Рекомендуется работать так, чтобы между кистью и пластинкой всегда располагался слой электролита. Все время работы проводки должны быть смоченными раствором. Пластинка на глазах будет покрываться слоем металлической меди красного цвета. Для обработки маленькой детали понадобятся считанные минуты.
Когда вы нанесли покрытие, нужно высушить на воздухе деталь и натереть матовый слой меди до блеска с помощью суконной или шерстяной тряпки. Процесс меднения алюминия, когда изделие в электролитическую ванну не опускают, а обрабатывают небольшими участками снаружи, добавляя электролит, применяют в таких случаях, когда изделие настолько велико, что для него нельзя подобрать подходящую ванны.
Ванны меднения
Установки для меднения от обыкновенных гальванических ванн ничем не отличаются. Электролиты для меднения довольно просто получить, если иметь под рукой необходимые ингредиенты. Бывают два вида медных растворов: щелочные и кислые.
Электролиты для меднения довольно просто получить, если иметь под рукой необходимые ингредиенты. Бывают два вида медных растворов: щелочные и кислые.
В кислых растворах вы не сможете получить хорошо сцепленные покрытия из меди на цинковых и стальных изделиях, потому что цинк и железо в этом случае растворяются с медью, и нарушается сцепление с защитным покрытием.
Для устранения данной особенности рекомендуется первый тонкий медный слой (2—3 мкм) создать в щелочном растворе для меднения, а в будущем наращивать покрытие до заданной толщины в кислом электролите, который является более экономичным. Цинковые изделия, что имеют сложную форму, лучше всего меднить в щелочных электролитах.
Самыми распространенными кислыми электролитами являются борфтористоводородные и сернокислые. Наибольшее использование нашли сернокислые электролиты, которые отличаются простотой состава, высоким выходом по току и значительной устойчивостью.
Перед меднением деталей из стали в кислых электролитах их рекомендуется предварительно меднить в цианистом электролите или осаждать тонкий подслой никеля. Данные электролиты имеют несколько недостатков.
Данные электролиты имеют несколько недостатков.
Один из них состоит в невозможности непосредственного покрытия цинковых и стальных деталей из-за контактного выделения меди, которая имеет плохое сцепление с металлом основы. Также электролиты незначительную рассеивающую способность и более грубую структуру осадков по сравнению с прочими электролитами.
Среди щелочных электролитов меднения известны пирофосфатные и цианистые электролиты.
Цианистые электролиты из меди характеризуются высокими рассеивающими способностями, возможностью проведения меднения столярных изделий и мелкокристаллической структурой осадков.
К недостаткам щелочных электролитов относят низкую плотность тока и неустойчивость раствора вследствие карбонизации под действием двуокиси углерода свободного цианида. Помимо этого, цианистые электролиты отличаются уменьшенным выходом по току — не больше 60-70%.
Таким образом, медь является металлом, который используется повсеместно: в автомобильной промышленности, электротехнике и строительстве. А в гальванопластике известна технология меднения для подготовки металлической поверхности под покрытие другими металлами или как самостоятельный процесс.
А в гальванопластике известна технология меднения для подготовки металлической поверхности под покрытие другими металлами или как самостоятельный процесс.
Меднение и его электролиты
Гальваническое осаждение меди было открыто в 1838 г., русским академиком Б.С. Якоби и с того времени широко применяется во всех отраслях промышленности.
Медь — пластичный и легко полирующийся металл с плотностью 8,9 г/см3 и температурой плавления 1084 °С. Теплопроводность меди 1,38 МДж/(м-°С), а удельное электрическое сопротивление 0,0175 Ом-мм2/м. Атомная масса меди 63,57. В химических соединениях, входящих в состав электролитов, медь одновалентна или двухвалентна. Так, в цианистом медном электролите комплексное соединение меди содержит одновалентную медь, а в сернокислом электролите медный купорос имеет в своем составе двухвалентную медь. Соответственно и электрохимический эквивалент меди равен 2,372 и 1,186 г/А-ч.
Стандартный потенциал меди 0,34 В. Гальванически осажденная медь имеет красивый розовый цвет, но в атмосферных условиях легко реагирует с влагой и углекислотой воздуха, а также с сернистыми газами, которые находятся в атмосфере промышленных городов, покрываясь окислами и изменяя свой цвет. Медь интенсивно растворяется в азотной, медленнее в хромовой кислотах; значительно слабее в серной и почти не реагирует с соляной кислотой. Из органических кислот на медь не действует уксусная. Из щелочей ее легко растворяет аммиак.
Благодаря своей пластичности и свойству легко полироваться медь широко применяется в многослойных защитно-декоративных покрытиях типа медь — никель — хром в качестве промежуточной прослойки. Как самостоятельное покрытие медь применяется для местной защиты стальных деталей от цементации, азотирования, борирования и прочих термодиффузионных способов обработки поверхности деталей. Велико значение толстослойных медных покрытий в гальванопластике, которая применяется для снятия металлических копий с художественных изделий и для получения медных деталей сложного профиля.
Электролиты и режимы меднения
Существующие электролиты меднения подразделяются по своему составу на щелочные и кислые.
К группе щелочных электролитов относятся цианистые и нецианистые электролиты: железистосинеродистые, пирофосфатные и др. Основными из щелочных электролитов являются цианистые электролиты, являющиеся непревзойденными по качеству осажденной меди, высокой рассеивающей способности, возможности создания мелкокристаллической структуры покрытий.
В качестве растворимых анодов применяют либо пластины из чистой меди, либо сборные аноды из небольших пластинок фосфористой меди. При использовании медных анодов применяют медь, соотношение площади медной пластины к площади покрываемых деталей должно быть не менее 2:1. При применении в качестве анода пластинок из фосфористой меди их засыпают в плоские решетчатые корзины. Для цианистых электролитов каркасы корзин выполняют из нержавеющей стали, а для сернокислых — из титана. Стенки корзин изготовляют из перфорированного листового винипласта или пентапласта. При необходимости допускается пользование нерастворимыми анодами из стали марки 08Х18Н10Т или другой нержавеющей стали.
При необходимости допускается пользование нерастворимыми анодами из стали марки 08Х18Н10Т или другой нержавеющей стали.
Для составления щелочного цианистого электролита используются следующие материалы:
- цианистая медь CuCN — желтоватый порошок, нерастворимый в воде, но растворимый в цианистом натрии, весьма ядовита;
- цианистый натрий NaCN — весьма ядовит.
Приготовление такого двухкомпонентного электролита весьма несложно и заключается в постепенном введении расчетного количества цианистой меди в концентрированный раствор цианистого натрия или калия и нагревании до 60-70 °С при интенсивном перемешивании. После образования раствора комплексной соли меди его анализируют на содержание свободного цианистого натрия и корректируют в случае необходимости, после чего разбавляют электролит водой до заданного объема и приступают к эксплуатации без какой-либо предварительной проработки. Окончательный состав (г/л) двухкомпонентного цианистого электролита и режимы его работы следующие:
- цианистая медь -50-70;
- цианистый натрий (свободный) — 10-25;
- температура, °С — 15-30;
- плотность тока, А/дм2 — 1,0-3,0;
- катодный выход по току, % — 50-70;
- величина рН -10-11.

При плотностях тока более 2 А/дм2 допускается реверсирование тока в соотношении 10:1. Скорость осаждения меди для всех цианистых электролитов определяется по табл. 5.12 в зависимости от плотности тока и выхода по току, который для различных электролитов может колебаться в больших пределах.
Остальные цианистые электролиты отличаются от описанного выше лишь различными добавками, либо ускоряющими в какой-то мере процесс осаждения, либо улучшающими внешний вид покрытий. К таким добавкам относятся, например, сегнетова соль (калий-натрий виннокислый), которая вводится для растворения пассивной пленки на анодах. Ее вводят в состав электролита в количестве до 50-70 г/л. Блескообразующие добавки пока не нашли широкого применения при цианистом меднении.
Щелочные нецианистые электролиты призваны заменить токсичные цианистые электролиты на безвредные, или, в крайнем случае, на менее токсичные, хотя они несколько уступают по эффективности их использования.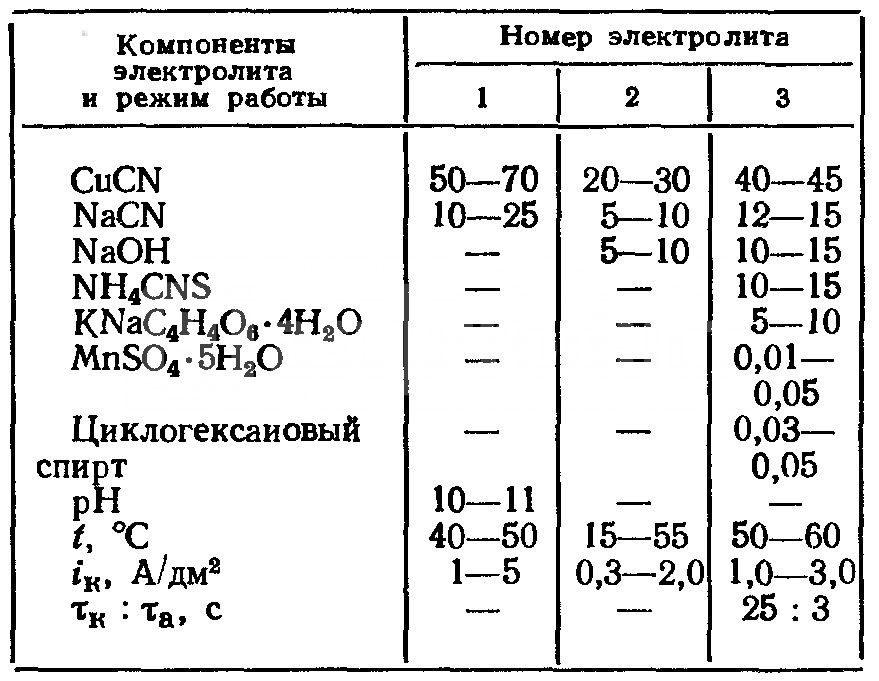
Таблица 5.12. Скорость осаждения меди и занисимости от плотности тока и ныхода по току.
|
Плотность тока, А/дм2 |
Скорость осаждения меди (мкм/ч) при выходе по току, % |
|||||
|
40 |
50 |
60 |
70 |
80 |
90 |
|
|
0,5 |
5,3 |
6,6 |
7,9 |
9,3 |
10,7 |
12,0 |
|
1,0 |
10,7 |
13,2 |
15,9 |
18,6 |
21,3 |
24,0 |
|
2,0 |
21,4 |
26,4 |
31,9 |
37,2 |
42,6 |
48,0 |
|
3,0 |
32,1 |
39,6 |
47,9 |
56,0 |
63,9 |
74,0 |
|
4,0 |
42,8 |
52,8 |
63,8 |
74,4 |
85,2 |
96,0 |
|
5,0 |
53,5 |
66,0 |
79,0 |
93,0 |
107,0 |
120,0 |
К электролитам, наиболее приближающимся по своим свойствам к цианистым, следует отнести железистосинеродистый электролит, составленный на основе железистосинеродистого калия и сегнетовой соли. Электролит обладает высокой рассеивающей способностью, однако содержит некоторое количество цианистых комплексных солей, образующихся во время эксплуатации электролита. Для него рекомендуются следующие состав (г/л) и режим работы:
Электролит обладает высокой рассеивающей способностью, однако содержит некоторое количество цианистых комплексных солей, образующихся во время эксплуатации электролита. Для него рекомендуются следующие состав (г/л) и режим работы:
- сернокислая медь (в пересчете на металл) — 20-25;
- железистосинеродистый калий (общий) — 180-220;
- сегнетова соль — 90-110;
- едкое калий — 8-10;
- температура, °С — 50-60;
- плотность тока, А/дм2 — 1,5-2,0;
- выход по току, % — 50-60.
Следующим электролитом, получившим производственное применение, хотя и весьма ограниченное, является пирофосфатный электролит. В состав электролита, кроме сернокислой меди, входят следующие компоненты:
- пирофосфорнокислый натрий Na4P2O7;
- фосфорнокислый натрий двухзамещенный Na2HPO4.

При составлении электролита каждый компонент растворяется отдельно в горячей воде, а затем все растворы сливают в рабочую ванну и доводят водой до заданного объема. Готовый электролит имеет темно-синий цвет и содержит комплексные соединения, в которых медь двухвалентна. Рассеивающая способность электролита намного ниже, чем у цианистых. Кроме того, при меднении стальных деталей в этом электролите их следует завешивать под током во избежание выпадения контактной меди. Для удовлетворительной работы электролита весьма важно поддерживать величину рН строго в заданных пределах. Наиболее известный состав (г/л) и режим работы приведены ниже:
- сернокислая медь — 30-50;
- натрий пирофосфорнокислый — 120-180;
- натрий фосфорнокислый двухзамещенный — 60-100;
- температура, °С — 45-55;
- величина рН — 7,0-8,0;
- плотность тока, А/дм2 — 1,0-1,5;
- выход по току, % — 70-80.

Используются медные аноды, поверхность которых должна в 2-3 раза превышать площадь загружаемых деталей. Скорость осаждения меди из этого электролита весьма мала и составляет 3-4 мкм/ч. Механическое перемешивание электролита позволяет повысить рабочую плотность тока до 1 А/дм2.
Из кислых электролитов наиболее широко применяемым является сернокислый. Кроме него известны борфтористоводородный и сульфаминовый электролиты. Кислые электролиты характеризуются простотой состава, устойчивостью в эксплуатации и высоким выходом по току. Их основными недостатками являются низкая рассеивающая способность и невозможность непосредственно осаждать медь на сталь вследствие выпадения контактной меди.
Из кислых электролитов наиболее общепринятым является сернокислый. В простейшем своем виде он состоит всего из двух компонентов. Состав (г/л) и режим работ этого электролита следующие:
- сернокислая медь — 150-250;
- серная кислота — 50-70;
- температура, °С — 15-25;
- плотность тока, А/дм2 — 1,0-8,0;
- выход по току, % — 95-98.

При перемешивании электролита сжатым воздухом или при прокачивании его с непрерывной фильтрацией можно работать при катодной плотности до 6-8 А/дм2, а при вращении цилиндрических деталей на катоде плотность тока может доходить до 30-40 А/дм2, что бывает необходимо при наращивании слоя меди большой толщины, например в гальванопластике. Для получения гладких и блестящих покрытий в сернокислый электролит вводят блескообразователи.
В табл. 5.13 представлены сведения по скорости осаждения меди из кислых и нецианистых электролитов.
|
Плотность тока, А/дм2 |
Скорость осаждения меди (мкм/ч) при выходе по току, % |
|||||
|
95 |
96 |
97 |
98 |
99 |
100 |
|
|
1,0 |
12,5 |
12,6 |
12,7 |
12,9 |
13,1 |
13,2 |
|
5,0 |
63,5 |
63,0 |
63,5 |
64,5 |
65,6 |
66,2 |
|
10,0 |
125,0 |
126,0 |
127,0 |
129,0 |
131,0 |
132,5 |
|
20,0 |
250,0 |
252,0 |
254,0 |
258,0 |
262,0 |
265,0 |
Для получения гладких покрытий при больших скоростях наращивания меди необходимо пользоваться электролитами на основе борфтористоводородной или сульфаминовой кислоты. Такие электролиты позволяют применять плотности тока в 10-15 А/дм2 не только при меднении, но и при нанесении других гальванических покрытий. Ниже приведены состав (г/л) и режим работы борфтористо-водородного электролита:
Такие электролиты позволяют применять плотности тока в 10-15 А/дм2 не только при меднении, но и при нанесении других гальванических покрытий. Ниже приведены состав (г/л) и режим работы борфтористо-водородного электролита:
Таблица 5.13. Скорость осаждения меди из кислых и нецианистых электролитон.
- борфтористоводородная медь — 3-40;
- борная кислота — 15-20;
- борфтористоводородная кислота — 15-18;
- температура, °С — 15-25;
- плотность тока, А/дм2 — до 10;
- выход по току, % — 99;
- величина рН — 1,0.
Электролит перемешивают сжатым воздухом или механической мешалкой. Аноды — медные. Корректировку электролита производят углекислой медью и борфтористоводородной кислотой.
Возможно Вас так же заинтересуют следующие статьи: comments powered by HyperComments| ⇣ Содержание Казалось бы, в мире гигагерцев и наносхем слово «батарейка» выглядят архаизмом. В действительности же, батарейки не только выжили, но и обеспечили энергией современный мир. Большинство из сегодняшних электронных устройстви игрушек — цифровые камеры, mp3 плееры, PDA, ноутбуки, — не могут обойтись без элементов питания. Заметим, что современные батарейки сильно отличаются от своих прародителей. Требования современных устройств диктуют направления развития индустрии элементов питания. Производители прикладывают огромные усилия, чтобы минимизировать их размеры для обеспечения дальнейшей миниатюризации современной техники. Последние инновации в производстве батареек направлены на удовлетворение нужд цифровых устройств. Дело в том, что современные цифровые камеры, цветные PDA, mp3 плееры работают несколько иначе, чем электрические фонарики или старинные радиоприёмники. Производители батареек знают, что удвоить ёмкость элементов не так-то просто. Чудес не бывает. Принципы работы химических реакций, на которых основана работа батареек, всем давно известны. В настоящее же время производители совершенствуют технологии. Последнее значительное достижение химии — литий-полимерные батареи — хотя и известны уже около десяти лет, пока всё ещё остаются не у дел, так как ни разработчики компьютеров, ни производители батарей, не знают, как лучшим образом использовать весь потенциал этих элементов — например, их способность принимать разнообразные геометрические формы, нетрадиционные для обычных аккумуляторов. Если на горизонте и появится что-то принципиально новое, то это будет энергетическая система, лишь внешне похожая на обычную батарейку. На самом деле это не совсем батарейка — это топливный элемент. Десятилетиями инженеры и ученые подходили к этой идее. Эта диковинка вырабатывает энергию химическими методами более эффективно, нежели другие. Такая батарейка ещё пока экзотика, и она очень дорога (и велика, к тому же) для повседневного использования. Тем не менее, как надеются некоторые производители, через несколько лет компьютеры и сотовые телефоны будут постоянно работать несколько дней без подзарядки. Топливные элементы: жидкий метанол в качестве источника энергииТопливные элементы идеально подходят для персональных компьютеров. По прогнозам инженеров, ноутбук сможет работать на них 20 часов без подзарядки. Для того чтобы зарядить батарейку, вам просто придётся заполнить элемент жидким метанолом — эта несложная и безопасная операция обеспечит работу компьютера на том же самом элементе в течение следующих 20 часов. Самое удивительное в этих прогнозах то, что инженеры считают такое возможным уже к концу 2001 года. С использованием этой же технологии сотовые телефоны придётся перезаряжать лишь раз в неделю. В конце концов, закончится это тем, что на такой энергии будут ездить автомобили, а кто-то, возможно, даже построит собственную электростанцию для обеспечения всех домашних нужд. И такое решение будет эффективнее традиционного и экологически чище. Хотя топливные элементы и открывают новые перспективы, идея эта совсем не нова. Англичанин сэр Вильям Гроув (William Grove) первым разработал принципы функционирования топливных элементов в 1839. Начиная с 1960х NASA стала использовать щелочные топливные элементы в космосе. Уже сейчас серийно выпускаются электростанции на топливных элементах с мощностью до 200 кВт. В действительности же, ещё в 1900 году инженеры предрекли великое будущее топливным элементам — они превзойдут другие технологии и станут главным источником энергии в промышленности и транспорте. Прошло всего сто лет. Как и многие другие великие идеи, эта была отложена — технологии того времени не могли обеспечить запросы науки. В частности, для того, чтобы разработать топливные батарейки для ноутбуков, пришлось ждать создания новых пластмасс и технологий их фабричного производства. Сегодняшняя дороговизна энергии и высокие требования к уровню загрязнения привели к тому, что начались исследования и коммерческое развитие новых топливных технологий. Топливные элементы долго созревали, и теперь они почти готовы выйти в широкое производство. Коммерческие изделия поступят в продажу уже в этом или следующем году. Топливная батарейка никогда не изнашивается. Как и у обычной батарейки, у топливной есть и анод, и катод. Но в отличие от обычной, во время химических реакций масса электродов топливной батареи никогда не меняется: вместо этого, топливо служит в качестве источника свободных электронов и электрических полей, а электроды выполняют функции катализатора. Как и обычные батареи, топливные элементы основываются на простой реакции окисления/восстановления (oxidation/reduction reaction), но реакция происходит в топливе, а не на электродах. Топливный элемент производит электроэнергию, пока в него поступает топливо (и пока элемент может избавляться от окисленного старого топлива). Анод в топливном элементе, как правило, опущен в топливо, а катод собирает и обеспечивает доступ к окислителю (часто в роли окислителя выступает атмосферный кислород). Прохождение реакции не влияет на электроды, так как между ними находится ионопроводящая мембрана. У топливных элементов существует несколько преимуществ. Главное, эти элементы намного более эффективны по сравнению с любыми другими способами генерации электрической энергии, особенно с двигателями внутреннего сгорания. Эффективность уже существующих элементов составляет 50%, что в два раза выше ДВС (берущих начало с цикла Карно). Электроэнергия в элементах вырабатывается непосредственно из химических реакций, в этом случае не требуется промежуточных механических звеньев, используемых в большинстве электростанций (атомных, угольных, газовых) и также снижающих эффективность. Кроме того, следует отметить экологическую чистоту и удобство топливных элементов. Движущихся частей в таких батареях либо вообще нет, либо крайне мало. Например, электростанции, работающие на топливных батареях, хотя и могут использовать топливные насосы, но топливные батареи не требуют коленчатых валов, поршней или клапанов. Портативные батареи вообще не имеют движущихся частей. Они не выделяют токсичных веществ и работают практически бесшумно. Тем не менее, топливные элементы производят два типа выделений: тепловые и химические. Реакция окисления, происходящая внутри топливного элемента, похожа на реакцию горения. Таким образом, эта реакция, как и реакция горения, экзотермическая, то есть выделяет тепло. Во время работы топливные батарейки нагреваются. Элементы в батарее могут нагреваться до 50-100 градусов. Большие элементы, работающие на электростанциях, раскаляются до 1000 градусов. В таких случаях этому теплу находят применение — оно идёт либо на обогрев помещений, либо на подогрев воды. Вдобавок ко всему, топливные элементы выделяют химические вещества — отработанное (окисленное) топливо. В отличие от отходов при других способах получения электроэнергии, эти химические отходы безвредны. В основном, экологически чистые элементы в качестве топлива используют чистый водород, который в паре с кислородом (в качестве естественного окислителя) выделяет в качестве отходов обыкновенную воду. Элементы, использующие углеводородное топливо, такое как метанол, выделяют воду и углекислый газ, который затем попадёт в атмосферу. В отличие от ДВС, большинство топливных элементов работает при более низких температурах, а химические реакции тщательно контролируются. Поэтому они не засоряют воздух как ДВС: они просто не разогреваются до температуры, на которой вырабатывается закись азота. Так как технологии по созданию топливных элементов появились сравнительно недавно, цена у топливных элементов выше, чем у других источников электроэнергии. Поэтому в массовую эксплуатацию они вводятся в основном из-за своих преимуществ — они экологически чистые и бесшумные. Высокая цена обуславливается зародышевым состоянием технологии производства этих элементов. Но благодаря интенсивному развитию технологий, в недалеком будущем цена на топливные элементы будет сопоставима с ценой на традиционные источники питания. В дальнейшем, быть может, они станут наиболее экономичным способом получения электроэнергии. Самой обещающей технологией для питания портативных устройств, таких как ноутбуки и сотовые телефоны, пожалуй, является технология топливных батарей на метаноле (Direct Methanol Fuel Cell). Именно основываясь на этой технологии, Роберт Хокадэй (Robert Hockaday), физик Лос-Аламосской национальной лаборатории, разработал топливную микро-батарею, претендующую на коммерческий успех. В соответствии с этой технологией элементы производятся следующим образом: создаётся тонкая слоистая плёнка, которая затем сворачивается в большой рулон и приобретает форму стандартных батареек. Основной недостаток метаноловых элементов заключается в токсичности топлива. Другие похожие технологии используют этанол (винный спирт), но их эффективность значительно ниже. В скором будущем, топливные элементы станут очень популярны. По крайней мере, уже две компании — Siemens (в сотрудничестве с Фраунгоферовским институтом по установкам на солнечной энергии, Фрайбург, Германия) и Samsung продемонстрировали экспериментальные топливные батареи для портативных компьютеров. Компании показали потенциал технологий топливных элементов, но стоит отметить, что образцы были ручной сборки, и о массовом производстве речь не шла. Ещё в 1990 году компания Хокадэя, Energy Related Devices Inc продемонстрировала экспериментальный сотовый телефон на топливных элементах. Это было первое устройство, проработавшее непрерывно 24 часа. При определённых доработках, это решение могло бы быть запущено в массовое производство. Некоторые компании, такие как PowerZyme LLC, публично предлагали наладить производство таких элементов к концу года. Но до настоящего времени ни один завод не объявил о начале массового производства топливных элементов питания для ноутбуков или сотовых телефонов. Батареи имеют уже довольно большую историю, и у них ещё многое впереди. Сначала мы дадим краткую историческую справку о батареях и технологиях, затем мы окунемся в современные батарейные технологии. Как мы надеемся, эта статья поможет вам лучше понимать возможности батарей, их использование и обслуживание в портативных компьютерах, средствах связи и графических устройствах. Кроме того, мы расскажем о более экзотических технологиях, которые могут ждать нас в будущем. ПредысторияБатарея — устройство для накопления энергии. Такое определение можно дать и маховику, и часовой пружине, и дровам. Однако когда речь идёт о современных технологиях, под батареей обычно понимают автономную химическую систему, производящую электроэнергию — портативный источник питания для фонариков, видеокамер, ноутбуков. В компьютерных технологиях батареи находят себе следующее применение: в качестве источника питания ноутбуков, для хранения параметров BIOS, для систем бесперебойного питания и для беспроводных периферийных устройств, таких как мыши и клавиатуры. Каждая из этих областей выдвигает свои специфические требования к источникам питания. В итоге элементы отличаются не только размерами, формой, ценой, но также и химической технологией. В других современных устройствах используются те же батарейки, что и в персональных компьютерах. Так, например, у сотовых телефонов такие же требования к источникам питания, что и у ноутбуков. Поэтому и элементы питания используются те же самые. Общая черта современных батареек заключается в том, что все они основаны на химических реакциях, работающих по одному и тому же принципу. Эти внутренние реакции в терминах химии — редоксы — сокращение от reduction-oxidation — окислительно-восстановительные реакции. Это означает, что батареи работают за счет окисления и восстановления молекул — то есть за счёт перетягивания ионов кислорода от одних молекул к другим. Такой же процесс окисления происходит и при реакции горения. Только в этом случае реакция происходит быстрее и она менее контролируема. Во время окислительно-восстановительных реакций (при освобождении электронов из молекул) вырабатывается побочный продукт — создаётся электрический ток, способный нагреть нить накала лампочки фонарика или обеспечить работу сложной электронной схемы в компьютере или другом устройстве. По этому принципу работают все современные батареи. Анод и катод, созданные из различных материалов (строго говоря, они должны обладать различным окислительным потенциалом, его ещё часто обозначают как E0), связаны друг с другом посредством третьего материала, называемого электролитом. Выбор материала для обоих электродов и для электролита достаточно широк, именно поэтому мы видим такое разнообразие батарейных технологий. Кроме того, от выбора материала зависит энергетическая плотность элемента (то есть количество энергии, которую может хранить батарея определённого веса и размера) и номинальное выходное напряжение. Вы можете создать элемент питания в домашних условиях — с помощью лимона, полоски цинка и полоски меди. Сложнее будет тем, у кого дома нет ни цинка, ни меди. :) По всей вероятности элементы питания изобретали дважды. По данным археологов, еще доисторические люди пользовались электрохимическими элементами, которые сегодня мы бы назвали батарейками. В 1932 году в Багдаде было сделано интересное открытие: возможно, возраст элементов питания — около двух с половиной тысяч лет. Первый примитивный элемент питания состоял из железного стержня, опущенного в медный цилиндр. Предположительно, была еще и жидкость, служившая электролитом. Только она не сохранилась до наших дней. Такое устройство было немногим сложнее металлических полосок в лимоне, оно вырабатывало ток, достаточный для нанесения слоя ценных металлов гальваническим методом, что позволяло меди сверкать как золото или серебро. Второй раз элементы питания были изобретены при изучении анатомии лягушек. Началось всё с опытов итальянского физика и анатома Луиджи Гальвани (1737-1798), производимых в Болонском университете. Было замечено, что если подвергнуть мышцы на лапках лягушки воздействию статического электрического заряда (полученного с помощью лейденской банки), то они сокращаются. В опытах по биоэлектрогенезу (так были названы сокращения мышц, коленный рефлекс) Гальвани также заметил сокращение мышц, если к ним приложить два разных металла. Он сделал вывод, что мышцы вырабатывают электричество. С тех пор имя Гальвани ассоциировано с электричеством — сегодня процесс получения электричества с помощью химических реакций называется гальванизмом (galvanism). Более значительный вклад для истории элементов питания сделал друг Гальвани по переписке, итальянский физик Алессандро Вольта (1745-1827). Вольта работал в университете в Паве, там он достиг тех же результатов, что и Гальвани. Но Вольта на этом не успокоился и провел серию собственных экспериментов. Вольта создал первый элемент питания. После этого, их отношения с Гальвани несколько охладели. Вольта сделал вывод, что причиной сокращения мышц лягушки стало электричество, вырабатываемое при соприкосновении двух различных металлов. Этот вывод противоположен выводу Гальвани. Чтобы доказать своё предположение, Вольта наполнил чашу соляным раствором и погрузил в неё две металлических дуги: одну — медную, вторую — цинковую. Это устройство, первый современный элемент питания, вырабатывало электричество за счет химических реакций металлов в растворах. К 1800 году Вольта упростил устройство батареи. Теперь батарея представляла собой стопку пластинок, где между металлическими пластинками из меди или цинка находилась пластина из кожи, пропитанной раствором соли. В результате получилась так называемая гальваническая батарея, вырабатывающая электрический ток. Единица измерения электрического потенциала — Вольт — была названа в его честь. Достижения Вольта были использованы и в дальнейших экспериментах по созданию новых элементов питания. Во-первых, была улучшена электрохимическая система Вольта. Например, в 1836 году английский химик Джон Фредерик Даниел поместил свинец и цинк в сосуд с серной кислотой, так возник плоскостный элемент или элемент Даниела. Тремя годами позже, Вильям Роберт Гроув добавил окислительный агент, чтобы скапливающийся на катоде во время работы элемента водород не уменьшал напряжение. В двухсоставном элементе питания Гроува анод из амальгамированного цинка погружался в неполяризующийся электрод с серной кислотой, который, в свою очередь, помещался во второй сосуд, содержащий азотную кислоту и платиновый катод. Немецкий химик Роберт Вильгельм Бунзен (более известный как создатель бунзеновской горелки, а не как исследователь электричества) доработал в 1841 году элемент Гроува — он заменил дорогой платиновый электрод дешевым угольным. Ни один из этих примитивных элементов не дожил до наших дней. Первое значительное изобретение сделал Гастон Плантэ, разработавший в 1859 году во Франции свинцовый аккумулятор. Впервые элемент питания обрел успех. Это была подзаряжаемая батарея. Похожие электрохимические элементы с доработанной упаковкой используются в современных автомобильных аккумуляторах. Кроме того, такие же элементы, заправляющиеся желеобразным электролитом, используются в системах бесперебойного питания. Следующим важным достижением было создание жидкостных элементов. Впервые они были изобретены и запатентованы Джорджем Леклончем в 1866 году. Леклонч использовал катоды из диоксида марганца, смешанного с углем и цинковые аноды в форме стержня. В качестве электролита использовался раствор нашатыря. Технология Леклонча дожила и до настоящего времени в виде самых дешевых элементов — углецинковых — использующихся в электрических фонариках. Но такие элементы, в том виде, в каком они были изобретены, были громоздкими и непрактичными. Кое-кто пытался их герметизировать. Так, например, в 1881 году Ж.А.Тибо (J.A.Thiebaut) предотвратил вытекание жидкого электролита, поместив и цинковый катод, и электролит в манжетный уплотнитель. А современная пластмасса сделала технологию Леклонча незаменимой в некоторых областях. Одноразовые батарейки PolaPulse (производства Polaroid), работающие в фотокомплектах одноступенного процесса используют химические процессы, разработанные Леклончем, только они выполнены в другой оболочке. Из школьного учебника физикиНапряжение описывает электрический потенциал батареек, от него зависит сила, действующая на электроны в электрической цепи. Существует ещё один физический термин — электродвижущая сила, ЭДС. С другой стороны, электрический ток характеризуется количеством электронов, которое может обеспечить электрический потенциал. Электрический ток измеряется в амперах, в честь французского физика и математика Андре Мари Ампера (1775-1836). Мощность — произведение напряжения и силы электрического тока — измеряется в Ваттах, в честь шотландского инженера-изобретателя Джеймса Уатта(1736-1819). Напряжение у батареек с одной стороны, остаётся постоянным, с другой стороны, постоянно изменяется. Попробуем объяснить эту фразу: напряжение характеризуют химические реакции, протекающие в батареях, и эти реакции не изменяются. Но кроме этого, напряжение зависит и от температурного режима, в котором работает элемент питания (в большинстве батарей при снижении рабочей температуры падает и напряжение), и от возраста батарейки (чем она старее, тем меньше напряжение), и от нагрузки (чем больше тока они расходуют, тем меньше становится напряжение). В результате всех этих факторов, реальное напряжение может значительно отличаться от номинального. В начале своей жизни элементы питания могут давать напряжение до 1,8 вольт и могут оставаться годными к использованию, пока напряжение не упадёт до 0,8 вольт. Из-за такого широкого разброса современные устройства либо разрабатываются не чувствительными к напряжению, либо просто регулируют его, и внутренние схемы всегда получают одинаковое напряжение. Именно поэтому вы можете использовать и углецинковые (с номинальным напряжением 1,5 вольт), и никель-кадмиевые (1,2 вольта), и литиевые дисульфидные (lithium disulfide — 1,6 вольт) элементы. В зависимости от химических реакций одинаковые элементы могут давать напряжение от доли вольта, до более чем трёх вольт. Элементы, дающее напряжение выше трёх вольт, как правило, составные. (Хотя мы и привыкли называть батарейкой любой элемент питания, с технической точки зрения термин «батарея» означает собрание нескольких отдельных электрохимических элементов.) Из-за своего устройства, элементы питания дают ограниченный электрический ток. Теоретически, если бы химическая реакция в элементе протекала мгновенно, элемент за это время мог выработать, скажем, неограниченный ток. Но существуют факторы, ограничивающие скорость прохождения химических реакций, а, следовательно, и производимый ток. Основными факторами являются скорость реакции химических элементов, устройство элемента и площадь, на которой протекают эти химические реакции. Соответственно, существуют и элементы, способные создавать большой ток и элементы, создающие только слабые токи. Например, ток, вырабатываемый свинцовыми аккумуляторами и никель-кадмиевыми батареями, настолько велик, что при коротком замыкании можно плавить металл и зажечь огонь! Если положить никель-кадмиевую батарейку в карман, она может замкнуться о ключи или мелочь, а при замыкании при таких высоких токах существует вероятность воспламенения. Поэтому, обычно на таких батарейках можно прочесть предупреждения. Размер элементов питания определяет выбор химических реакций, а, следовательно, влияет и на вырабатываемый ток. Чем больше размер элемента, тем больший ток он способен выработать. Поэтому сверхмощные устройства зачастую требуют более крупных элементов. Батарейки размера «D» производят больше тока, чем батарейки размера «AA». Все эти различные факторы можно свести к одному: на вырабатываемый ток влияет эквивалентное внутреннее сопротивление элемента. Чем оно ниже, тем выше ток. Емкость батарейки вычисляется как количество электричества, или электрического заряда, вырабатываемого при определённых условиях полностью заряженной батарейкой. Как и с напряжением, реальный заряд батарейки изменяется в зависимости от температуры и тока разрядки. В науке единицей измерения емкости батареек является кулон (в честь французского физика Шарля Огюстена Кулона, 1736-1806). Именно ёмкость описывает количество времени, в течение которого элемент питания способен вырабатывать определённый электрический ток. Один кулон равен одному амперу, произведённому за одну секунду. На практике же, обычно, ёмкость батареек измеряется в ампер-часах, что в 3600 раз больше кулона. Общее количество энергии батарейки вычисляется как ёмкость, умноженная на напряжение, и измеряется в ватт-часах. Батарейки не могут хранить энергию вечность. Химические элементы в батарейках неминуемо вступают в реакцию и постепенно портятся. В результате разряжается сама батарейка. Разряд батарейки может происходить в двух формах. Некоторые химические реакции постоянно влияют на способность элементов хранить химическую энергию. Через некоторое время элементы питания теряют заряд и превращаются в тяжелые красиво раскрашенные цилиндры. Время, в течение которого элементы сохраняют работоспособность, называется сроком годности. Срок годности определяется устройством батареек, химическими реакциями и условиями хранения. Некоторые батарейки, такие как современные литиевые, имеют срок годности, превышающий десятилетие, некоторые же портятся в считанные недели (например, цинково-воздушные — после начала эксплуатации). Плохие условия хранения — особенно высокие температуры — ускоряют разряд батареек. Если же хранить элементы питания в холодных условиях, срок их годности увеличится. В подзаряжаемых элементах обратимые химические реакции, в результате которых создаётся электричество, протекают, даже если не использовать батарейку. Правда, скорость таких реакций невелика. Такое явление получило название саморазряда. Как и после обыкновенного разряда, батарейку можно будет просто подзарядить. Скорость такого саморазряда зависит от тех же факторов, от каких зависит и срок годности батареек. Хотя в современных батарейках основными факторами являются всё же устройство и типы химических реакций. Например, некоторые химические составы теряют до десяти процентов заряда в день, а некоторые — менее процента. Соотношение ёмкости к весу (размеру) батарейки называют плотностью батарейки. Чем она выше, тем большее количество энергии может вырабатывать элемент определённого размера и веса, и соответственно тем больше такой элемент востребован — по крайней мере, если вам доводилось целый день носить с собой ноутбук с батарейкой, то вы поймёте. В следующей таблице представлена плотность элементов большинства химических типов для персональных компьютеров и сотовых телефонов. Плотность представлена ватт-часами на килограмм.
Далее будут рассмотрены — устройство элементов питания, углецинковые, свинцовые, никель-кадмиевые, никель-металлгидридные, литий-ионные аккумуляторы, литий полимерные и литий-железодисульфидные элементы, цинково-воздушные аккумуляторы, технологии подзарядки. А так же — системы обеспечения бесперебойного питания, питание периферийных устройств, батарейки материнских плат и т.д… Устройство элементов питанияБатарейки — это химические устройства, но мы часто забываем об их происхождении — ведь вся химия, как правило, скрыта от глаз. Нам видны лишь различия в размере и в напряжении. Наверное, каждый, кто получал в подарок устройство без батареек, оценивал размер элементов. Как правило, батареек нужного размера никогда нет под рукой. Огромное разнообразие стандартов всё же лучше их полного отсутствия. Например, большинство батареек для ноутбуков не стандартизованы, и как следствие, очень дороги. Во многих случаях вы становитесь заложниками производителей батарей, заложниками их ценовой политики. В принципе, существуют сторонние производители, предлагающие подзаряжаемые батареи. Многие с недоверием относятся к качеству, безопасности и сроку службы таких элементов питания, хотя в большинстве случаев они успешно справляются с задачами. Батареи же стандартных размеров в большом ассортименте представлены многими производителями, к тому же, такие элементы значительно дешевле аккумуляторов. Основные современные стандарты распространяются на углецинковые элементы. В принципе, другие технологии (некоторые разновидности литиевых, никель-кадмиевых, и никель-металлгидридных элементов) также следуют этим же стандартам. В стандартах определяются размеры батареей. Таким образом, устройства могут работать на батарейках от различных производителей. В следующей таблице приведены стандартные размеры батареек.
Несмотря на использование различных химических процессов, электрические показатели у них одинаковые. Поэтому они взаимозаменяемы не только по размерам, но и по электрическим параметрам. При этом следует заметить, что это не означает их полной идентичности — все слабые и сильные стороны проявляются в конкретных применениях. Сухие элементыПрогресс в батарейной технологии не мог ждать появления новых пластмасс. Поэтому, ученые пошли другим путём — они разработали химические процессы, позволяющие избежать использования неудобных жидкостей вообще. Заслуга в создании удобных сухих элементов принадлежит Карлу Гасснеру из города Майнца. Он запатентовал сухие элементы ещё в 1887 году. Несмотря на различные технологические доработки, современные сухие элементы всё же основаны на концепции, разработанной Гасснером. Большинство современных экзотичных подзаряжаемых батарей — никель-кадмиевые, никель-металлгидридные, множество литиевых батарей — это разработки двадцатого века, результаты исследований различных лабораторий крупных корпораций и университетов. Принципы устройства и работы батарей давно известны, поэтому новых химических процессов экспериментальным путём никто не придумал. Основные же работы ведутся в области усовершенствования и оптимизации химических процессов. С точки зрения химии, гальванические элементы разделяются на два типа: первичные и вторичные. То есть одноразового и многоразового использования. Различаются они способами вырабатывания энергии. В одноразовых элементах электричество вырабатывается из химической реакции, постоянно изменяющей элемент питания. В процессе разрядки — извлечения электричества из элемента — анод, катод и электролит необратимо изменяются. В таком случае после разрядки элемент попадает на пункт приёма вторсырья. В перезаряжаемых элементах химические реакции могут протекать и в обратном направлении, при этом элемент будет накапливать электричество, а не тратить его. В отличие от первого типа, эти элементы аккумулируют электричество, потому и называются аккумуляторными батареями. Ещё их называют подзаряжаемыми (rechargable). При прочих равных такие батареи кажутся лучше. Они уменьшают количество вредных химикалий, попадающих на свалку, так как вы не выкидываете их при разрядке. Но по практическому сравнению с обычными элементами, у подзаряжаемых элементов имеется несколько недостатков. Химическое устройство подзаряжаемых элементов зачастую менее удобно, чем у обыкновенных элементов. Например, большинство подзаряжаемых элементов работает на агрессивных жидкостях, которые сложнее хранить — они менее стабильны. Инженеры создали одноразовые элементы, остающиеся годными даже через десять лет хранения. Что же касается аккумуляторов, практически все они сравнительно быстро теряют свой заряд. Немногие аккумуляторы сохраняют хотя бы часть своего изначального заряда через год работы или бездействия. Перед тем как использовать, аккумуляторы необходимо заряжать, а это требует источника электричества нужного напряжения и нужного тока. В некоторых устройствах использование аккумуляторов не оправдано с практической точки зрения. Особенно, когда речь идёт о максимально дешевых переносных устройствах. Согласитесь, доплачивать 10 долларов за зарядное устройство для аккумуляторов к игрушке или фонарику за 2 доллара явно не имеет смысла. В экстремальных ситуациях более удобны простые гальванические (одноразовые) элементы — они всегда готовы к использованию и практически целиком заряжены. Для часто используемых устройств более эффективно использовать аккумуляторы (как правило, из экономических соображений). Химические типыВажнейшим фактором при разработке батареек считается количество энергии, которое может хранить элемент определенного размера. Ведь источник питания должен обеспечивать работу устройства, по крайней мере, какое-то определённое время. Химические реакции, протекающие в элементе — наиболее важный фактор, определяющий энергетическую плотность и полезность батарейки. История батареек, на самом деле, это история поиска и улучшения химических реакций для увеличения плотности. Сегодняшние батарейки используют множество различных химических реакций. Некоторые были описаны ещё в конце 19 века, некоторым едва исполнилось десять лет. Каждая из них обладает своими преимуществами при использовании в различных видах устройств. Далее мы рассмотрим наиболее популярные типы химических батарей для ноутбуков, сотовых телефонов, систем питания и периферийных устройств. УглецинковыеБатарейные технологии начинают отсчет именно с этого типа. Прообраз этого элемента был изобретён в 1866 году Джорджем Леклончем. Углецинковые элементы считаются наиболее распространёнными и имеют множество различных названий. Когда вы говорите о батарейках, вы, скорее всего, имеете в виду именно эти батарейки. К слову сказать, одна только компания — Energizer — за год продаёт шесть миллиардов таких элементов. На сегодняшний день, это самые дешевые элементы, кроме того, это элементы с наименьшей плотностью среди большинства батареек. Причиной их популярности стали названные химические процессы. К числу таких батареек относятся элементы Леклонча, цинк-хлоридные и щелочные элементы. В углецинковом элементе катодный токосъемник изготовлен из угля. Он представляет собой угольный стержень, проходящий по оси батарейки. На самом деле катод состоит из смеси диоксида марганца, угля и электролита. Анод выполнен из цинка и представляет собой сам корпус элемента питания. Электролит — это сложная смесь химикалий (клейстер), обычно включающая нашатырь, диоксид марганца и хлорид цинка. Элементы Леклонча и цинк-хлоридные элементы отличаются в основном электролитом. В первом типе в качестве электролита используется разбавленная водой смесь нашатыря и хлорида цинка. В цинк-хлоридных, в основном, это хлорид цинка. Напряжение в цинк-хлоридных элементах немного больше, чем в элементах Леклонча — 1,6 Вольта, против 1,55. Несмотря на то, что цинк-хлоридные элементы и имеют большую емкость, нежели элементы Леклонча, это разница незаметна при небольших нагрузках. Поэтому цинк-хлоридные элементы часто называют сверхмощными. В любом случае, чем выше нагрузки, тем меньше эффективность углецинковых элементов. Скажем, при увеличении тока нагрузки в два раза, емкость батарейки сокращается более чем наполовину. Поэтому чем больше тока потребляет устройство, тем больше будет размер батарейки. Именно поэтому прожорливые в энергетическом смысле устройства работают на элементах размера «D», а маломощные радиоприёмники будут работать и на элементах «АА». Щелочные элементы (независимо от того, что говорят в рекламе) — это все лишь небольшое улучшение углецинковой технологии 19 века. Основные изменения коснулись химического состава электролита — он стал более щелочной (а чего ещё вы ожидали?). Такое изменение позволило увеличить плотность и срок годности элементов питания. Конструкция же щелочных элементов во многом отличается от конструкции обычных углецинковых. Для улучшения эффективности, их устройство было кардинально изменено. Корпус щелочных элементов служит просто для защиты, и не играет никакой роли в химических реакциях. Анод этих элементов представляет желеобразную смесь активного цинка и электролита (который сам по себе представляет смесь гидроксида калия (являющегося щелочью) и воды). Оба этих компонента связаны с отрицательным полюсом элемента с помощью медного стержня, проходящего по оси элемента. Катод, смесь угля и диоксида марганца, размещается вокруг анода и электролита и отделяется слоем нетканого материала вроде полиэфира. На рисунке представлена конструкция щелочного элемента Duracell. Щелочная батарейка Duracell В зависимости от сферы применения, щелочные элементы могут работать в 4-9 раза дольше обыкновенных углецинковых элементов. Преимущество их неоспоримо при редко возникающих больших нагрузках, то есть если мощное устройство работает около часа в день, а не по несколько минут каждый час. Номинальное напряжение углецинковых элементов — 1,5 Вольта. Но это напряжение обеспечено лишь при небольших токах в самом начале их эксплуатации. Напряжение уменьшается при увеличении нагрузки и при уменьшении заряда. В стандартных девятивольтных батарейках используются те же химические реакции. Для обеспечения такого напряжения внутри каждой батарейки последовательно соединяется шесть углецинковых элементов. В принципе, подобным образом можно достичь ещё большего напряжения. В пятидесятых годах для работы ламповых приёмников батарейки давали напряжение от 45 до 90 Вольт. Они тоже состояли из углецинковых элементов. Как правило, щелочные батарейки не подзаряжаются. В них не могут протекать обратные химические реакции. Если же вы попытаетесь подзарядить обычную углецинковую батарейку, она скорее станет работать как резистор, а не как аккумулятор и будет просто нагреваться. При очень сильном токе батарейка разогреется до состояния, при котором возможен взрыв — хороший повод никогда не экспериментировать с подзарядкой углецинковых или щелочных элементов. Как и у любого правила, здесь тоже есть исключения — восстанавливаемые батарейки Renewak, производимые по лицензии корпорации Rayovac Corporation (данная технология возникла сравнительно недавно). Устройство этих батареек основано на двух углецинковых технологиях, оно отличается от устройства обыкновенных батареек. Что важно, для зарядки таких батареек требуются специальные зарядные устройства. Вместо обыкновенного постоянного тока их заряжают пульсирующим током. В зарядных устройствах эти импульсы управляются микропроцессором, именно он определяет, когда нужно дать напряжение и защищает батарейку от перегрева. Но даже такие нестандартные зарядные устройства не обеспечивают батарейкам долгой жизни. Обычно её хватает на 25-100 перезарядок. Тем временем цена на такие элементы в два раза выше, чем на обыкновенные щелочные. Но в некоторых случаях их использование может быть экономически оправдано. Свинцовые элементыБольшинство аккумуляторов в мире — свинцовые. В основном их используют для пуска двигателей автомобилей. Прообразом этих элементов стали разработки Плантэ. В них также есть аноды, сделанные из ячеистого свинца, и катоды — из оксида свинца. Оба электрода погружены в электролит — серную кислоту. Из-за свинца эти батареи очень тяжелы. А так как они залиты высококоррозийной кислотой (которая также утяжеляет аккумуляторы), они становятся ещё и опасными, требующими особого внимания. Кислота и испарения могут повредить соседствующие объекты (особенно металлические). А если переусердствовать с зарядкой, может начаться электролиз воды, находящейся в кислоте. При этом вырабатывается водород, взрывоопасный газ, который при определённых условиях может взорваться (как в случае взрывов Хинденбурга). Разложение воды в батарее может привести и к другому эффекту: ведь общее количество воды в батарее уменьшается. При этом уменьшается площадь реакции внутри батареи, соответственно, уменьшается и емкость аккумулятора. Кроме того, уменьшение жидкости позволяет батарее разряжаться под воздействием атмосферы. Электроды могут шелушиться и вообще закоротить батарею. Первые свинцовые аккумуляторы требовали регулярного ухода — было необходимо поддерживать нужный уровень воды/кислоты внутри каждого элемента. Так как в батарее подвергается электролизу только вода, заменять необходимо только её. Чтобы избежать загрязнения батареи, производители рекомендуют использовать для обслуживания только дистиллированную воду. Обычно батарею доливают до нормального уровня. Если на батарее нет метки, её необходимо доливать так, чтобы жидкость закрывала пластины электродов внутри. В неподвижных устройствах, корпус у батарей выполнен из стекла. Оно не только хорошо держит кислоту, но и позволяет обслуживающему персоналу без особых трудностей определять состояние элементов. В автомобильной технике требуются более прочные корпуса. Инженеры для этих целей воспользовались эбонитом или пластиком. После того, как элементы стали герметизировать, удобство использования таких свинцовых аккумуляторов стало бесценным. В результате появились так называемые необслуживаемые батареи. Так как испарения так и остаются внутри элементов, потери от электролиза сводятся к минимуму. Поэтому такие батареи и не требуют заправки водой (по крайней мере, не должны). Но это не значит, что у таких батарей вовсе не возникает проблем с обслуживанием. Всё равно внутри плещется кислота. И эта кислота может вытечь через батарейные клапаны. При этом могут повредиться батарейные отсеки или даже оборудование, где она установлена. Инженеры избегают такой ситуации двумя способами. Можно содержать кислоту внутри пластикового сепаратора между электродами элемента (обычно, он сделан из микропористого полиолефина или полиэтилена). Либо можно смешать электролит с другим веществом, чтобы в результате получился гель — например, с коллоидальной массой наподобие желатина. В результате утечка не происходит. Кроме опасной начинки, у свинцовых батарей есть и другие недостатки. Как было отмечено выше, они очень тяжелые. Количество энергии, которое содержится в единице массы у таких батарей меньше, чем в батареях практически любых других технологий. Это единственное, чем не удовлетворены создатели автомобилей, которые бы с большим удовольствием использовали эти недорогие свинцовые батареи в электрокарах. С другой стороны, хотя эти батареи и дешевые, они насчитывают 150 летнюю историю. Технология позволяет модернизировать аккумуляторы для специальных нужд, например для использования в устройствах с большими циклами разряда (где батареи используются в качестве единственного источника питания) или в устройствах обеспечения бесперебойного питания, например, в больших центрах обработки информации. Свинцовые батареи также обладают низким внутренним сопротивлением и поэтому могут вырабатывать очень большие токи. В отличие от более экзотичных элементов, к примеру, никель-кадмиевых, они не подвержены эффекту памяти. (Этот эффект, применительно к никель-кадмиевым элементам, сокращает емкость батареи, если перезаряжать её ещё до того, как она полностью разрядится.) Кроме того, такие батареи достаточно долго живут и они предсказуемы. И, конечно же, они дешевы. Источники бесперебойного питанияВ большинстве таких источников используются свинцовые аккумуляторы с желеобразным электролитом. Обычно, такие устройства неприхотливы в обслуживании. Это значит, вы не задумываетесь об их обслуживании. Источники питания, тем не менее, довольно громоздки — ведь внутри находятся аккумуляторы. Будучи полностью заряженными, элементы с желеобразным электролитом постепенно портятся под воздействием постоянного слаботочного заряда. (Большинство свинцовых аккумуляторов содержатся в полностью заряженном состоянии). Поэтому такие элементы требуют специальных зарядных устройств, которые бы автоматически отключались, как только элемент полностью зарядится. Зарядное устройство должно снова включаться, как только аккумулятор разрядится до предопределённого уровня (не важно, под воздействием ли нагрузки, или в результате саморазряда). Обычно источники бесперебойного питания регулярно проверяют заряд аккумулятора. Никель-кадмиевые аккумуляторы (NiCad)В потребительской электронике, большинство аккумуляторов — никель-кадмиевые. Это самый популярный тип подзаряжаемых батареек. Обычно их обозначают NiCad. Катоды в таких элементах сделаны из никеля, а аноды — кадмиевые. Больше всего в таких элементах ценится их емкость и способность перезаряжаться большое количество раз. Обычно такие элементы остаются пригодными к работе даже после 500-1000 циклов перезарядки. Кроме того, такие элементы относительно легки, и имеют довольно высокую плотность (хотя она в два раза меньше обычных щелочных). Таким элементам не страшна непрерывная подзарядка (по крайней мере, при правильном осуществлении). Минусом в никаль-кадмиевых элементах считается их токсичность (кадмий — яд) — об этом можно прочесть на обечайке. Выходное напряжение большинства химических элементов уменьшается по мере разряда. Это происходит по причине того, что реакции, происходящие внутри батарейки, увеличивают её внутреннее сопротивление. Никель-кадмиевые элементы обладают очень низким внутренним сопротивлением, а это означает, они могут вырабатывать высокие токи, которые не сильно изменяются по мере разрядки батарейки. Соответственно, такие элементы могут создавать практически постоянное напряжение до тех пор, пока целиком не разрядятся. Как только такие элементы разряжаются целиком, напряжение резко падает. Такое постоянное напряжение очень ценится разработчиками электроники — теперь им не приходится создавать вариаторы напряжения. Но эта же черта не позволяет вычислять степень заряда батарейки. В результате, большинство ноутбуков, к примеру, не проверяют состояние батарейки каждый раз, а вычисляют степень заряда аккумулятора исходя из количества часов, которое она проработала, и её номинальной емкости. Ещё одним недостатком никель-кадмиевых батареек считается эффект памяти. Некоторые элементы, не будучи полностью разряженными, при дозарядке могут терять мощность. Химия объясняет такой эффект просто — в результате преждевременной перезарядки на анодах элементов возникают кристаллы кадмия, уменьшающие площадь реакции. Возникновение этих кристаллов называется эффектом химической памяти. Такая химическая память запоминает вторичное состояние разряда аккумулятора. Когда батарейка разряжается до этого состояния, мощность батарейки резко падает, даже несмотря на оставшуюся емкость. Если такой элемент продолжать заряжать из этого состояния, ситуация только усугубится — будет сложнее привести аккумулятор в нормальное состояние. При последующих циклах перезарядки из этого состояния батарея ещё лучше его «запомнит». Для того же, чтобы целиком восстановить емкость аккумулятора и избавиться от этого эффекта запоминания, необходимо разряжать аккумулятор так, чтобы он миновал состояние вторичного разряда. С практической стороны, вылечить аккумулятор можно сильно разрядив его — до уровня, чтобы он едва работал, и затем целиком зарядив его. Но это не означает, что нужно полностью разряжать аккумулятор. Так можно испортить практически любой элемент. Например, если разряжать никель-кадмиевый аккумулятор до напряжения одного вольта (при номинальном напряжении в 1,2) — то можно его погубить. Ноутбуки же отключаются еще до того, как батарейка полностью разряжается. Поэтому можно не заботиться о чрезмерной разрядке батареек. И еще: не пытайтесь разрядить аккумулятор с помощью короткого замыкания — вы рискуете испортить батарею и устроить пожар. Хотя практикой это и не подтверждается, но если верить производителям батарей, современные никель-кадмиевые и никель-металлгидридные батарейки лишены этого недостатка. Некоторые производители литиевых элементов утверждают, что эффект памяти образуется под воздействием никеля, а не кадмия. С таким выводом не согласны химики, а пользовательский опыт наводит на противоречивые сведения. В любом случае, для эффективного использования никель-кадмиевых аккумуляторов, для обеспечения максимального срока службы, лучше пользоваться ими равномерно, по нормальному циклу. Заряжать полностью, и использовать до нормального уровня разряда, затем снова заряжать до конца. Предотвращение электролизаКак и в свинцовых аккумуляторах, в никель-кадмиевых батарейках возможен электролиз — распад воды в электролите на потенциально взрывоопасные водород и кислород. Производители батареек предпринимают различные меры для предотвращения этого эффекта. Обычно элементы для предотвращения утечки герметично упаковывают. Кроме того, батарейки устроены так, чтобы сначала вырабатывался не водород, а кислород, который предотвращает реакцию электролиза. Для того чтобы герметичные аккумуляторы не взрывались, и чтобы в них не скапливался газ, обычно в батарейках предусматривают клапаны. Если закрыть эти вентиляционные отверстия, то возникнет опасность взрыва. Обычно эти отверстия настолько малы, что остаются незамеченными. Работают они автоматически. Это предостережение (не закрывать вентиляционные отверстия) относятся в основном к производителям устройств. Стандартные отсеки для батареек предполагают возможность вентиляции, но вот если залить батарейку в эпоксидной смоле, то вентиляции не будет. Никель-металлгидридные аккумуляторы (Ni-MH)С точки зрения химии, лучшим материалом для катода батареек был бы водород. Но создать такой катод проблематично. При обычных температуре и давлении водород легче воздуха, и его очень трудно удержать. В конце шестидесятых ученые обнаружили, что некоторые металлические сплавы позволяют хранить атомарный водород в объёмах, в тысячи раз превосходящие собственные. Эти сплавы называются гидридами и обычно состоят из таких соединений как LiNi5 или ZrNi2. В хорошо продуманных системах гидриды могут позволить хранить много водорода, который может вступить в обратимые реакции. В большинство аккумуляторов, использующих гидридные катоды, аноды сделаны из никеля — как и в никель-кадмиевых. Обычно в качестве электролита в таких элементах используется разбавленный раствор гидроксида калия, щелочь по природе. На рисунке представлено устройство никель-металлгидридной батарейки Duracell. Никель-металлгидридная батарейка Duracell При замене кадмия гидридом достигаются некоторые преимущества. Во-первых, конечно же, это удаление токсичного кадмия. Отсутствие кадмия означает также и то, что у аккумулятора не должен наблюдаться эффект памяти. Вдобавок, использование водорода в катодах приводит к тому, что плотность у аккумуляторов повышается на пятьдесят процентов в сравнении с никель-кадмиевыми элементами. Практически это означает, что батарейка такого же размера и такого же веса может питать ноутбук в полтора раза дольше. Никель-металлгидридные аккумуляторы, часто обозначаемые как Ni-MH, всё же не совершенны. Основным недостатком таких элементов является большая, в сравнении с никель-кадмиевыми элементами, скорость саморазряда. Некоторые никель-металлгидридные элементы теряют до пяти процентов своей емкости за сутки. Заметьте, это показатели современных аккумуляторов. Как и в никель-кадмиевых элементах, в никель-металлгидридных выходное напряжение составляет 1,2 вольта, и оно остаётся относительно постоянным в течение всего цикла разряда. При дальнейшем разряде оно резко падает. (В полностью заряженном состоянии никель-металлгидридные элементы вырабатывают напряжение в 1,4 вольта, но оно быстро снижается до 1,2 — такой уровень считается основным на протяжении всего цикла разрядки.) Во многих случаях никель-металлгидридные аккумуляторы можно заменять никель-кадмиевыми. У них практически одинаковые электрические показатели — и те, и другие способны вырабатывать высокие токи, хотя у никель-кадмиевых этот показатель и выше. Никель-металлгидридные аккумуляторы могут выдержать большое количество циклов подзарядки, обычно до 500, но всё равно с никель-кадмиевыми их не сравнить. Несмотря на то, что характеристики разряда никель-металлгидридных и никель-кадмиевых элементов практически одинаковы, процесс заряда этих аккумуляторов различен. Особенно эта разница заметна в тепловых режимах — никель-кадмиевые аккумуляторы эндотермичны, а никель-металлгидридные — экзотермичны, то есть при подзарядке они выделяют тепло. Как только они приближаются к состоянию полного заряда, их температура значительно увеличиваются. Соответственно, для каждого из этих типов аккумуляторов должны быть разработаны свои зарядные устройства. Лучше всего подзаряжать никель-металлгидридные аккумуляторы с помощью специальных зарядных устройств. Тем не менее, они прекрасно выносят и непрерывную подзарядку малым током. Литий-ионные аккумуляторыЛитий — наиболее химически активный металл. На его основе работают современные источники питания для ноутбуков. Практически все высокоплотные источники питания используют литий в силу его химических свойств. Килограмм лития способен хранить 3860 ампер-часов. Для сравнения, показатель цинка — 820, а у свинца — и вовсе 260. В зависимости от типа анода, литиевые элементы могут создавать напряжение от полутора до 3,6 вольт, что выше, чем у любых других элементов. Проблема заключалась в том, что литий слишком активен. Он настолько бурно реагирует с водой, что может воспламениться. Коммерческое производство простых литиевых элементов началось в семидесятых. А уже в восьмидесятых некоторые компании стали серийно выпускать литиевые аккумуляторы. Такие батарейки быстро завоевали репутацию батареек с сомнительной безопасностью. Для того чтобы решить эту проблему, создатели аккумуляторов пересмотрели технологию и стали использовать литий в ионном состоянии. Таким образом, был использован потенциал лития при приемлемом уровне безопасности. В таких элементах ионы лития находятся в активных веществах электродов, а не в металлических пластинах. Обычно в таких элементах анод сделан из угля, а катод — из литийкобальтдиоксида. В качестве электролита обычно используется соляной раствор лития. Литиевые батареи имеют большую плотность, нежели никель-металлгидридные. Такие элементы работают без подзарядки в ноутбуках в полтора раза дольше никель-металлгидридных. Кроме того, в литий-ионных элементах не наблюдаются эффекты памяти, которыми славились ранние никель-кадмиевые элементы. С другой стороны, внутреннее сопротивление у современных литиевых элементов выше, чем у никель-кадмиевых. Соответственно, они не могут обеспечить больших токов. Если никель-кадмиевые элементы способны расплавить отвертку, то литиевые на это не способны, потому на их обечайках вы не найдёте предостережений. Но всё же, мощности в таких батарейках вполне хватит для обеспечения работы ноутбука без скачкообразных нагрузок (это значит, например, что определённые устройства, такие как жесткие диски, не должны вызывать высоких скачков нагрузки в определённых стадиях — например, при стадии раскрутки). Более того, даже не смотря на то, что литий-ионные батарейки выдерживают многократные подзарядки, такие батарейки живут меньше, чем те, в основе которых служит никель. Так как в литий-ионных элементах используется жидкий электролит (пусть даже запакованный в тканевую прокладку), обычно они имеют форму цилиндра. Хотя такая форма ничуть не хуже форм других элементов, с появлением полимеризированных электролитов литий-ионные элементы приобретают более компактные формы Литий полимерные элементы (Lithium Polymer)Наиболее перспективной из современных технологий считается доработка уже знакомых нам литиевых реакций и создание на их основе литий-твердополимерного элемента. В настоящее время большинство производителей аккумуляторов переключаются на эту технологию. Тогда как в традиционных литий-ионных элементах используется жидкий электролит, в твердополимерных элементах электролит запечатан в полимерную пластиковую прокладку, находящуюся между электродами аккумулятора. В качестве электролита такие элементы используют полимерные композиционные материалы (таких как полиакрилонитрил) с содержанием солей лития. Так как это вовсе не жидкость, а твердый материал, новые батарейки не требуют громоздких цилиндрических корпусов как у традиционных элементов. Вместо этого элементы производятся в форме плоских многогранников, которые легче умещаются в батарейные отсеки ноутбуков. Производители с радостью используют эту способность и компенсируют относительно невысокую плотность таких элементов (сравнимую с обыкновенными литий-ионными) тем, что используют батарейные отсеки целиком (включая те пустоты, которые бы возникали при использовании цилиндрических элементов). При этом эффективность использования этого пространства повышается на 22 процента. Литий-твердополимерные элементы экологически чище и легче обычных, так как не имеют металлической оболочки. Кроме того, они безопаснее, так как не содержат легковоспламеняющихся растворителей. Литий-железодисульфидные элементы (Lithium-Iron Disulfide)В отличие от других литиевых элементов, где стремятся увеличить плотность, в этих элементах реализовано компромиссное решение. Они разработаны для стандартных устройств со стандартным напряжением в 1,5 В (традиционные литиевые аккумуляторы вырабатывают вдвое большее напряжение). Поэтому на них можно часто встретить надпись «voltage-compatible lithium» — совместимы по напряжению. В отличие от других литиевых технологий, литий-железодисульфидные элементы не подзаряжаются. Внутренне такие элементы представляют собой слой литиевого анода, сепаратор, и железодисульфидный катод с алюминиевым катодным токосъемником. Эти элементы запечатаны, но имеют клапан для вентиляции. По сравнению со щелочными элементами (также не подзаряжаемыми), литий-железодисульфидные элементы легче (их вес составляет 66% от веса щелочных), у них выше ёмкость и срок службы. Даже если взять такой элемент со склада после десяти лет хранения, он будет практически полностью заряжен. Литий-железодисульфидные элементы легко выдерживают большие нагрузки. Они могут питать мощные устройства в 2,6 раза дольше щелочных элементов такого же размера. Но это преимущество незаметно при низких нагрузках. Например, при токе нагрузки в 20 мА, производители этих элементов размера AA указывают на них, что они проработают 122 часа, а производители щелочных — целых 135 часов. Совсем другую картину мы видим при увеличении тока нагрузки до 1 ампера — 2,1 часа против 0,8. Такие батарейки можно использовать там же, где и углецинковые элементы. Но свою цену они оправдывают только при высоких токах нагрузки — в больших фонариках, в устройствах с моторчиками и в мощной электронике. Использовать же их для питания часов или карманных радиоприемников — по крайней мере, не разумно. Цинково-воздушные аккумуляторы (Zinc-Air)Эти элементы отличаются самой большой плотностью из всех современных технологий. Причиной тому стали компоненты, используемые в этих аккумуляторах. В качестве катодного реагента в этих элементах используется атмосферный кислород, что нашло отражение в их названии. Для того чтобы воздух реагировал с анодом из цинка, в корпусе батарейки проделаны небольшие отверстия. В качестве электролита в этих элементах используется гидроксид калия, обладающий высокой проводимостью. Первоначально созданные как неподзаряжаемые источники питания, цинково-воздушные элементы характеризуется долгим и стабильным сроком хранения, по крайней мере, если хранить их герметично от воздуха, в неактивном состоянии. В этом случае за год хранения такие элементы теряют около 2 процентов емкости. Как только воздух попадает в батарею, эти батарейки живут не дольше месяца, независимо от того, будете вы их использовать, или нет. Некоторые производители начали использовать ту же самую технологию в подзаряжаемых элементах. Лучше всего такие элементы зарекомендовали себя при продолжительной работе в маломощных устройствах. Основным же недостатком этих элементов является высокое внутреннее сопротивление, означающее, что для достижения высокой мощности, они должны быть огромного размера. А это означает необходимость создания в ноутбуках дополнительных отсеков для батареек, по размеру сопоставимых с самим компьютером. Но следует отметить, что такое применение они начали получать совсем недавно. Первый такой продукт — совместное творение Hewlett-Packard Co. и AER Energy Resources Inc. — PowerSlice XL — показал несовершенство этой технологии при использовании в портативных компьютерах. Эта батарейка, созданная для ноутбука HP OmniBook 600 весила 3,3 кг — больше, чем сам компьютер. Работы же она обеспечивала всего 12 часов. Компания Energizer также стала использовать эту технологию в своих маленьких пуговичных батарейках, используемых в слуховых аппаратах. Подзарядка батарей — тоже не такое простое дело. Химические процессы очень чувствительны к электрическому току, подаваемому на батарейку. Если подаваемое напряжение будет слишком низким, то батарейка будет отдавать ток, а не принимать. Если напряжение будет слишком высоким, могут начаться нежелательные реакции, способные испортить элемент. Например, при поднятии напряжения обязательно будет повышаться и сила тока, в результате батарейка перегреется. А если продолжать заряжать элемент уже после того, как он будет целиком заряжен, в нем могут начать выделяться взрывоопасные газы и даже наступить взрыв. Технологии подзарядкиСовременные устройства для подзарядки — это довольно сложные электронные приборы с различными степенями защиты — как вашей, так и ваших батареек. В большинстве случаев для каждого типа элементов существует своё собственное зарядное устройство. При неправильном использовании зарядного устройства можно испортить не только батарейки, но и само устройство, или даже системы, питаемые батарейками. Существует два режима работы зарядных устройств — с постоянным напряжением и с постоянным током. Самыми простыми являются устройства с постоянным напряжением. Они всегда производят одно и то же напряжение, и подают ток, зависящий от уровня заряда батарейки (и от других окружающих факторов). По мере зарядки батареи, ее напряжение увеличивается, поэтому уменьшается разница между потенциалами зарядного устройства и батареи. В результате по цепи протекает меньший ток. Всё что нужно для такого устройства — трансформатор (для уменьшения напряжения зарядки до уровня, требуемого батарейкой) и выпрямитель (для выпрямления переменного тока в постоянный, используемый для заряда батареи). Такими простыми устройствами подзарядки пользуются для заряда автомобильных и корабельных аккумуляторов. Как правило, подобными же устройствами заряжаются свинцовые батареи для источников бесперебойного питания. Кроме того, устройства с постоянным напряжением используются и для подзарядки литий-ионных элементов. Только там добавлены схемы для защиты батареек и их хозяев. Второй вид зарядных устройств обеспечивает постоянную силу тока и изменяет напряжение для обеспечения требуемой величины тока. Как только напряжение достигает уровня полного заряда, зарядка прекращается. (Помните, напряжение, создаваемое элементом, падает по мере разряда). Обычно такими устройствами заряжают никель-кадмиевые и никель-металлгидридные элементы. Кроме нужного уровня напряжения, зарядные устройства должны знать, сколько времени нужно подзаряжать элемент. Батарейку можно испортить, если слишком долго подзаряжать её. В зависимости от вида батареи и от «интеллекта» зарядного устройства для определения времени подзарядки используется несколько технологий. В самых простых случаях для этого используется напряжение, вырабатываемое батарейкой. Зарядное устройство следит за напряжением батарейки и выключается в тот момент, когда напряжение в батарейке достигает порогового уровня. Но такая технология подходит далеко не для всех элементов. Например, для никель-кадмиевых она не приемлема. В этих элементах кривая разряда близка к прямой, и определить уровень порогового напряжения бывает очень сложно. Более «изощренные» зарядные устройства определяет время подзарядки по температуре. То есть устройство следит за температурой элемента, и выключается, или уменьшает ток заряда, когда батарея начинает нагреваться (что означает избыточность заряда). Обычно в такие элементы питания встраиваются термометры, которые следят за температурой элемента и передают зарядному устройству соответствующий сигнал. «Интеллектуальные» устройства используют оба этих метода. Они могут перейти с большого тока заряда на малый, или же могут поддерживать постоянный ток с помощью специальных датчиков напряжения и температуры. Стандартные зарядные устройства дают меньший ток заряда, чем ток разряда элемента. А зарядные устройства с большим значением тока дают больший ток, чем номинальный ток разряда батарейки. Устройство для непрерывной подзарядки малым током используют настолько небольшой ток, что он разве что не даёт батарейке саморазрядиться (по определению такие устройства и используются для компенсации саморазрядки). Обычно ток заряда в таких устройствах составляет одну двадцатую, или одну тридцатую номинального тока разряда батарейки. Современные устройства зарядки часто могут работать на нескольких значениях токов заряда. Сначала они используют более высокие значения тока и постепенно переключаются на низкие, по мере приближения к полному заряду. Если используется батарейка, выдерживающая подзарядку малым током (никель-кадмиевые, например, не выдерживают), то в конце цикла подзарядки устройство переключится в этот режим. Большинство зарядных устройств для ноутбуков и сотовых телефонов разработаны так, что могут быть постоянно подключены к элементам и не причинять им вреда. Спецификации интеллектуальных батарей (Smart Battery Specifications)Зарядные устройства могут получить не так-то много информации о состоянии батарейки. Для оптимизации подзарядки и для увеличения срока службы батарейки, зарядные устройства должны знать степень заряда батарейки, о предыдущих подзарядках, должны знать температуру и другие физические параметры. Другими словами, зарядное устройство должно владеть всеми этими данными для обеспечения нормальной работы системы зарядное устройство-батарейка. То есть зарядное устройство и батарейка должны представлять собой единую систему. Для обеспечения лучшей работы производитель батареек компания Duracell и компания Intel совместно разработали систему «умных» батареек (Smart Battery). Спецификация интеллектуальных батарей в первой версии (Smart Battery Data Specification, Version 1.0) вышла 15 февраля 1995 года. Она позволила упорядочить процессы заряда батареек с помощью добавления отслеживающей схемы в батареи и передачи стандартных сигналов на зарядное устройство. Система Smart Battery определяет нескольких уровней, распределяющих взаимодействие между батареей, зарядным устройством и компьютерам. Кроме того, она обеспечивает недорогой канал связи между этими устройствами, называющийся системной шиной (System Management Bus). Но кроме физического соединения, спецификация определяет протокол обмена сообщениями и формат сообщений. Спецификация интеллектуальных батареек определяет информацию о батарейке, которую она может передать зарядному устройству, равно как задает формат сообщений для ее передачи. В частности, зарядное устройство может получать информацию о химических процессах, о емкости, напряжении, и даже об упаковке батареи. Сообщения содержат не только информацию о текущем состоянии зарядки элемента, но также и историю всех предыдущих циклов подзарядки. Поэтому зарядное устройство может предсказывать срок службы элемента. Спецификация не зависит от используемых в элементе химических процессов и от устройства отслеживающей схемы. Единственное, что здесь должно четко соблюдаться — соединение с шиной и формат сообщений. В дополнение был создан стандарт интеллектуального зарядного устройства (Smart Battery Charger specification), который кроме описания данных, передаваемых между зарядным устройством и батарейкой, ещё и определяет отношения между «интеллектуальными» батарейками и различными типами зарядных устройств. Кроме этого он описывает системную шину и соответствующий стандарт интерфейса для BIOS, который предоставляет управление системой программному обеспечению PC и операционной системе. Практически все современные ноутбуки используют батареи, соответствующие этой спецификации, так как управление батареями входит в состав спецификаций ACPI (Advanced Configuration and Power Interface). Поддержка ACPI требуется для совместимости с последними версиями Windows. С помощью этого интерфейса производители компьютеров могут выбирать один из двух стандартов управления питанием: Smart Battery или недавно появившийся интерфейс управления батарей CMBatt (Control Method Battery Interface), описанный как часть стандарта ACPI. «Умная» батарея предоставляет аппаратный интерфейс (встроенный контроллер с регистрами), к которому операционная система компьютера может получить доступ через системную шину. Интерфейс CMBatt добавляет язык управления более высокого уровня, называемый AML — ACPI Machine Language — это встроенный язык стандарта ACPI. Он позволяет управлять работой батареек (равно как питанием системы и ее конфигурацией) с помощью или без помощи встроенного контроллера. Производители батареек и компьютеров преобразуют свои инструкции по подзарядке батареек и по отслеживанию состояния заряда в код AML, который, в свою очередь, предоставляет информацию операционной системе компьютера. Использование языка AML даёт производителям широкие возможности- один и тот же код может управлять различными типами батарей и интерфейсами связи. Чтобы продлить срок службы, их нужно эксплуатировать правильным образом. В случае неподзаряжаемых элементов, большое значение имеет способ хранения батареек. Если такой элемент правильно хранить в надлежащих условиях, он может всё это время целиком сохранять свой заряд. Относительно подзаряжаемых элементов, важно уметь правильно их подзаряжать. Батарейки используют тщательно выверенные химические реакции. Как и любые другие химические реакции, они зависят от температуры. Высокие температуры не только повышают скорость реакций саморазряда, они могут стать причиной непроизвольных химических реакций внутри элемента, в результате которых могут произойти необратимые процессы и батарейка перестанет вырабатывать электричество. Например, если хранить углецинковые элементы при температуре 20 градусов, они портятся значительно быстрее. Поэтому их рекомендуется хранить при более низких температурах. От температур ниже 0 эти элементы не испортятся, но от слишком низких температур они лучше работать не станут. Щелочные элементы хранятся лучше, чем стандартные углецинковые. При меньших температурах срок годности этих элементов увеличивается, но хранить элементы при низких температурах (ниже 20 градусов) не эффективно с экономической точки зрения. Если же хранить щелочные элементы при температуре выше 20 градусов — срок хранения будет меньше. Чем выше температура хранения, тем быстрее портятся батарейки. Срок годности литий-дисульфидных элементов довольно большой (10 лет) даже при комнатной температуре. Но если температура хранения будет выше, срок их годности значительно сократится. Все подзаряжаемые элементы питания плохо переносят перегрев. Не важно, был он вызван плохими условиями хранения, или неправильным подзарядом. Сильный перегрев в результате неправильной подзарядки может испортить практически любой аккумулятор. Большинство элементов при подзарядке нагреваются. Если же заряжать слишком долго, о них можно обжечься. Обычно такой сильный перегрев возникает из-за неисправностей зарядного устройства или при попытке подзарядить не разряженную батарею допотопным зарядным устройством. Ни один аккумулятор не разряжается полностью — разве что при коротком замыкании электродов. Некоторые элементы, если разрядить их сильнее положенного, могут поменять полярность. Поэтому если устройство предупреждает вас, что батарейка села, и выключается — не пытайтесь продолжать разряжать элемент. Многие подзаряжаемые элементы, в особенности никель-кадмиевые, лучше всего хранятся в разряженном состоянии. Поэтому батарейки в новых устройствах, как правило, не заряжены. На склады ноутбуки попадают с незаряженными аккумуляторами. В розничных же магазинах они, скорее всего, заряжаются непосредственно перед тем, как попасть на прилавок. Чтобы нейтрализовать эффект памяти, никель-кадмиевые элементы лучше использовать по возможности целиком и до конца разряжать перед подзарядкой. Например, чтобы во время бизнес-тура использовать всю емкость никель-кадмиевых элементов, необходимо непосредственно перед поездкой полностью их разрядить. Литий-ионные элементы, в отличие от никель-кадмиевых, не обладают эффектом памяти. А так как они выдерживают меньшее количество циклов разряда, перед поездкой лучше подзаряжать их не разряжая. Лучше всего с задачей выбора оптимального элемента для конкретного устройства справляются инженеры. Это их хлеб. У каждого устройства свои требования к элементам питания. В ряде случаев право выбора остаётся за вами. Например, в некоторых компьютерах могут нормально работать батарейки разных типов. К примеру, в периферийных устройствах выбор батарейки ограничен только размерами. В разных случаях правильный выбор элемента может зависеть от многих факторов — начиная химическими процессами заканчивая торговой маркой. НоутбукиСовременные ноутбуки очень противоречивы в требованиях к элементам питания. Во-первых, им нужна максимальная емкость. Во-вторых, ноутбуки требовательны к размерам и весу аккумуляторов. Выполнить всё это разом не является возможным, поэтому, как правило, приходится выбирать компромиссное решение. Большинство ноутбуков использует один из трех популярных типов подзаряжаемых батареек — никель-кадмиевые, никель-металлгидридные или литий-ионные. Производителей таких аккумуляторов не так и много. При выборе же в основном руководствуются соотношением времени работы и цены. Никель-кадмиевые элементы, как правило, наиболее дешевые, но и энергии они вырабатывают меньше. Литий-ионные батарейки могут работать вдвое дольше, но стоят на 50-75 процентов дороже. Никель-металлгидридные считаются золотой серединой. Как правило, выбирать приходится из того, что предлагает производитель компьютеров — ведь именно он разрабатывает дизайн отсека для батареек. Производители могут создавать такие отсеки индивидуально для каждой модели ноутбука. Хотя разработка такого персонального отсека имеет свои преимущества — например, такое решение позволяет производителю ноутбука оптимальным образом использовать имеющееся в компьютере место — это сковывает потребителя в выборе батареек. Обычно стоимость таких батареек крайне велика. Заметьте, большинство ноутбуков использует аккумуляторы стандартных размеров. Производители компьютеров покупают аккумуляторы точно так же, как и вы. Поэтому вы можете открыть батарейный отсек и поменять аккумулятор на новый. Но, как правило, в этом случае вы теряете гарантию как на батарейку, так и на ноутбук. Уровни продаж наиболее популярных ноутбуков достаточно высоки, так что совместимые источники питания от сторонних производителей также находят свой спрос. Из этого вы можете извлечь свою выгоду. Но учтите, что химические процессы накладывают свои ограничения на зарядные устройства, и если вы захотите использовать более мощные элементы на другой химии, удостоверьтесь, что ваше зарядное устройство сможет подзарядить такие элементы. Не стоит рисковать и ставить в ноутбук элементы питания, не рекомендованные производителем компьютера. Батарейки материнской платыДля того чтобы компьютер не забывал время в момент выключения, в большинстве систем имеются маленькие встроенные батарейки. Каждый производитель компьютеров по-своему смотрит на эти батарейки. Наиболее часто используются заменяемые кнопочные элементы, в основе которых — литий, и второй вариант — интегрированные модули со встроенными элементами. Обычно на материнской плате можно встретить литиевые батарейки. Присмотритесь и заметите крошечные металлические кругляши. В большинстве гнезд батарейки придерживает металлическая защелка, одновременно выступающая в качестве контакта на аноде. Чтобы заменить батарейку, можно высвободить её из гнезда с помощью отвертки. На её место нужно вставить новую, только удостоверьтесь, что она плотно попала на своё место. Что касается модулей, то чаще всего встречаются интегрированные модули от Dallas Semiconductor. Некоторые производители, чтобы сделать их заменяемыми, устанавливают их в гнезда. Но в большинстве случаев эти модули припаяны к плате. Теоретически, литиевые элементы, используемые в модуле, должны непрерывно проработать в течение десяти лет, и предполагается, что компьютер дольше не живет. Поэтому, теоретически, вам не придется их менять. Когда такая батарейка садится, компьютер, как правило, сам предложит вам её поменять. Если ваш компьютер регулярно забывает название диска, или каждый раз у вас неправильное время, скорее всего, наступил момент поменять батарейку. Системы обеспечения бесперебойного питанияТак как вес в таких устройствах роли не играет (в отличие от цены), то чаще всего используются свинцовые аккумуляторы. Чтобы обеспечить максимальное удобство в обслуживании таких устройств, в большинстве систем бесперебойного питания применяется желеобразный электролит. Зарядные устройства в этих системах достаточно сложны и превосходно выполняют свою работу подзаряжая (свинцовые аккумуляторы от непрерывной подзарядки малым током даже восстанавливаются) и предохраняя их от полного разряда. Лучшие системы бесперебойного питания периодически проверяют аккумуляторы, хватит ли их емкости для обеспечения работы на определенное время. Если вы пользуетесь источником бесперебойного питания, помните, что срок службы аккумулятора в нем ограничен. Через несколько лет желеобразный электролит уже не сможет обеспечить работы устройства даже на короткое время. Если не проверять периодически работоспособность аккумулятора, то незаметный выход их из строя может оказаться большим сюрпризом для вас — источник бесперебойного питания проработает не дольше нескольких секунд и тут же выключится. Проблема заключается в том, что элементы с желеобразным электролитом способны удерживать заряд всё время срока службы. Тем не менее, после трёх-пяти лет службы, они могут внезапно дать о себе знать — батарея может выти из строя уже через несколько недель после первого ухудшения. Неделю устройство ещё как-то проработает, а на следующую — откажет. Заметим, что такие аккумуляторы изнашиваются в независимости от того, активно ими пользовались, или нет. Они портятся даже если их не использовать вовсе. Хотя при повторяющихся сильных нагрузках срок их службы укорачивается быстрее. Чтобы предотвратить такого рода неприятности, в хороших системах обеспечения бесперебойного питания автоматические механизмы периодически проверяют емкость аккумулятора. Не следует пренебрегать сигналом о неисправности батареи. Следует немедленно её заменить. Заметим, что основную долю в стоимости таких систем составляет стоимость непосредственно аккумулятора. Если же вы захотите купить аккумулятор, чтобы заменить испортившийся, он обойдётся вам ещё дороже. В некоторых случаях бывает дешевле купить новую систему бесперебойного питания, чем поменять аккумуляторы в старом — особенно когда эту работу выполняют квалифицированные мастера. В больших и более дорогих устройствах, как правило, предусмотрены детали, облегчающие процесс замены аккумулятора. Например, в некоторых устройствах предусмотрен выдвижной отсек. Периферийные устройстваВ большинстве таких устройств используются батарейки стандартных размеров. Это позволяет вам найти оптимальное с экономической стороны решение. Отметка «heavy-duty» на углецинковых элементах это не пускание пыли в глаза. Таким способом помечают батарейки, используемые в фонариках и игрушках с моторчиками. В подобных приложениях с высоким потреблением электроэнергии такие элементы по сроку службы значительно превосходят обыкновенные. Когда же потребности в высоких токах не возникает (например, в настенных часах), преимущество таких элементов незначительно. И с экономической точки зрения традиционные элементы могут оказаться значительнее эффективнее. То же самое относится и к элементам с отметкой «super heavy-duty». Всё вышеизложенное не относится к литиевым элементам. Для устройств, потребляющих высокие токи, лучше использовать совместимые по напряжению (1,5 В) литий-сульфидные элементы. Но в маломощных устройствах, они работают хуже, чем батарейки других типов. Их размеры не отличаются от обычных щелочных элементов. Впрочем, некоторые типы литиевых элементов превосходно работают и в маломощных устройствах, например, в компьютерах используются кнопочные литиевые элементы напряжением в 3 Вольта. В устройствах, где тип элементов не важен (подзаряжаемый или одноразовый), если устройства должны работать много и долго, лучше использовать подзаряжаемые элементы. Несмотря на то, что они и стоят в 5-10 раз дороже обыкновенных элементов, их можно подзаряжать сотни раз. Хотя в старых подзаряжаемых элементах емкость и меньше, чем в неподзаряжаемых, современные никель-металлгидридные элементы таким недостатком не обладают. Тем не менее, подзаряжаемые элементы не стоит использовать в маломощных или в редко работающих устройствах. Высокая скорость саморазряда большинства подзаряжаемых элементов делает их малоудобными (скорее всего, вам придется подзаряжать их каждую неделю, в независимости от того, пользовались вы ими, или нет). Редко работающие устройства, например фонарики, требуют элементов, скорость саморазряда которых невысока — чтобы не случилось так, что в нужный момент в аккумуляторах не осталось энергии. Каждый производитель при производстве элементов проводит свои экспертизы. Отличия в элементах различных марок едва уловимы, но они могут играть важную роль в определенных приложениях. Например, производитель цифровых фотоаппаратов может порекомендовать пользоваться только определенным типом щелочных элементов. Журнал PC Magazine проводил своё исследование работы различных типов щелочных элементов на различных фотоаппаратах. Тесты показали огромную разницу в количестве снимков. Если сомневаетесь, сравните срок службы элементов различных марок в таких устройствах. Внутреннее сопротивление ограничивает ток, производимый батарейкой. Сопротивление углецинковых элементов сравнительно велико, поэтому эти элементы могут вырабатывать довольно невысокие токи — порядка нескольких сот миллиампер. Свинцовые, никель-кадмиевые, и никель-металлгидридные элементы обладают невысоким внутренним сопротивлением и могут вырабатывать токи огромной величины. Если замкнуть электроды таких батарей — то предмет, которым вы произведёте это замыкание (провод, полоска металла, монета в кармане), станет нагреваться вследствие своего сопротивления. Например, если замкнуть электроды заряженного автомобильного аккумулятора гаечным ключом, вы можете его расплавить. Если же по неосторожности замкнуть электроды никель-кадмиевого аккумулятора для ноутбука, можно устроить пожар. Будьте осторожны при обращении с аккумуляторами и не замыкайте их. Практически во всех подзаряжаемых элементах при чрезмерной подзарядке из-за электролиза вырабатывается водород. В герметичных элементах, используемых в современных компьютерах и сотовых телефонах, возможность воспламенения и взрыва водорода сведена к минимуму. Но такой шанс, хотя и небольшой, все ещё есть. Во всех таких аккумуляторах предусмотрены вентиляционные клапаны, которые открываются под сильным давлением, возникающим внутри элемента в результате электролиза. Шанс, что выходящий водород загорится, невелик. Тем менее вероятно, что произойдёт взрыв. Намного опаснее закупорить эти вентиляционные отверстия — в результате давление внутри элемента будет повышаться, что может привести к взрыву элемента даже без загорания газа. Никогда не затыкайте вентиляционные отверстия в подзаряжаемых элементах. Обычные элементы, как правило, герметичны. При сильном нагревании используемые внутри материалы могут испортиться и даже закипеть. Внутри элемента может образоваться давление, достаточное для взрыва. При попытке заряда неподзаряжаемого элемента, как и при его сжигании, может случиться взрыв. Практически во всех батарейках в той или иной степени содержатся вредные вещества. Свинец и кадмий являются токсичными металлами. Литий быстро вступает в химические реакции. Чистый литий, к примеру, может самопроизвольно вступать в реакцию с атмосферным кислородом и самовоспламениться. А при попытке потушить такой огонь, литий может вступать в реакцию и с водой. Хотя ртуть уже не используется в большинстве элементов, даже марганец, применяемый в углецинковых элементах, считается опасным. Все батарейки, так или иначе, представляют экологическую опасность. Поэтому старайтесь их правильно эксплуатировать. Некоторые производители начинают создавать средства по переработке использованных батареек. Не забывайте об экологии, пользуйтесь теми батарейками, которые можно отдать на вторичную переработку.
Если Вы заметили ошибку — выделите ее мышью и нажмите CTRL+ENTER. |
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмонияНа самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры — фторсерная и хлорсерная кислотыУ фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красоткаЭто — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?
Нейтрализация щелочи, щелочных вод и стоков
Завод водоочистного оборудования ООО «ПЗГО» приветствует всех на странице своего официального сайта, посвященной такой теме как нейтрализация щелочи, щелочных стоков и вод в промышленном масштабе.
Прежде чем перейти к теоретической части вопроса, хотелось бы обратить Ваше внимание на наши собственные недорогие, компактные и высокоэффективные очистные станции модельного ряда «ШВ», изготавливаемые по уникальным патентам и собственным многолетним наработкам.
Строго учитываем все аспекты Заказа: объем, агрессивность и концентрацию очищаемой среды, пространственное размещение станций, а также экономическую подоплеку Вашего производственного предприятия.
Для запроса цены или обсуждения тонкостей Вашего Заказа на систему очистки щелочных или кислых стоков, пожалуйста, контактируйте с Клиентским отделом ООО «ПЗГО» любым удобным способом или воспользуйтесь кнопкой ниже, и мы свяжемся с Вами в течение 1 часа рабочего дня.
Осведомиться о стоимости или заказать проектирование
Химические и физические свойства щелочей и их растворов
Щелочи, с химической точки зрения, представляют собой гидроксиды щелочных и щелочноземельных металлов (группы в периодической таблице – Ia и IIa). К таким металлам относятся натрий (образует каустическую соду), калий (едкое кали), барий (едкий барий), бериллий, стронций, унбинилий, литий, цезий, франций. Все щелочные растворы проявляют основные свойства, но не наоборот.
Одним из самых важных химических свойств оснований является активное вступление в реакцию с кислотами – реакция нейтрализации, ведущая к ассоциативному образованию солей и воды. Эта особенность широко используется при проектировании оборудования для нейтрализации промышленных выбросов.
Последствия, вызванные индустриальными стоками
Самая агрессивная щелочь – гидроксид цезия. Этот гидроксид более чем в 10 раз сильнее гидроокиси натрия или калия. Используется, в основном, лабораторно, но иногда – в качестве присадки для аккумуляторных электролитов.
Физически, эти соединения – твёрдые белые порошки (кристаллы), имеющие предельный коэффициент гигроскопичности, интенсивно поглощающие из воздуха воду, углекислый газ, а также другие газы и жидкости. Имеют высокий показатель растворимости в воде, что также берется в расчет при проектировании станций очистки стоков.
Кристалы едкого натра
Гигроскопичностью и экстремальной биологической опасностью алкалинов продиктованы крайне осторожные меры обращения с этими соединениями: щелочные ожоги кожи и дыхательных путей в значительной мере превосходят повреждения, полученные при равных обстоятельствах от кислоты.
В случае попадания гидроокиси на кожу, следует немедленно обезвредить ее разбавленным столовым уксусом – в крайнем случае – водой – и сразу обратиться к врачу.
Щелочные сливы предприятий
В очистке или нейтрализации стоков основного свойства нуждаются множественные производственные и обрабатывающие предприятия, а также лаборатории – независимые или прикрепленные к тому или иному предприятию. Рассмотрим основные направления.
-
Участки с установленным газоочистным оборудованием реагентного типа (скрубберы, абсорберы, газопромыватели). Аппараты мокрой газоочистки нередко имеют в виде побочного продукта слабые щелочные шламы, прямой слив которых в канализацию – в силу различных причин – нежелателен или запрещен.
- Гальванические цеха, процессы хромирования, никелирования, оцинкования. Жидкости со свойствами оснований используются в качестве электролита в гальванических ваннах.
-
Производство удобрений в аграрной промышленности.
- В нефтегазовой отрасли используется для подготовки высокосернистой нефти. Закачивают щелок и при нефтедобыче для увеличения отдачи нефтяных пластов.
-
Молочные, мясные хозяйства.
- Изготовление моющих средств, мыловарение.
-
Производство искусственных тканей, например, шелка.
- Фабрики строительных смесей: портланд-цемент, гипс, известь, алебастр.
-
Биологическая стерилизация прудов и других водоемов промышленного назначения.
- Широко применение и в химии, медицине, фармацевтике.
Стоит заметить, что проблемой утилизации сточных сливов обеспокоены не только те компании, которые используют сами щелочи, но, как правило, и те, в чьих технологических циклах участвуют калий, натрий, магний, кальций, стронций, барий, бериллий, литий, цезий.
Методы и способы нейтрализации щелочи
Основным водоочистным методом в промышленности является нейтрализация щелочи кислотой. Наш завод предлагает к расчету, изготовлению и продаже установки, реализующие нижеследующий метод очистки.
Реакция с кислотой
В основной бак установки заливается щелочной раствор. Система автоматически детектирует его концентрацию и через насос-дозатор подает в реактор необходимое количество кислого раствора, (состав которого зависит от очищаемой среды: азотная, серная, соляная и другие кислоты).
Принципиальная схема станции нейтрализации стоков. 1, 2 – резервуары для реагентов, 3 – главный бак-реактор, 4 – усреднитель (отстойник)
После это включается механическая мешалка, работа которой способствует более продолжительному контакту реагентов и более полному протеканию реакции. Параллельно с этим, в режиме онлайн, pH-датчиками идет сверка текущих показаний с заданными параметрами.
По достижении требуемого уровня pH мешалка выключается и включается центробежный насос, который сливает прореагировавший раствор в канализационную магистраль. Объем бака и реагента прямо зависит от потребностей Заказчика. Помимо прочего, установка может быть оснащена дополнительными емкостями для буферного хранения агентов, очищаемых или очищенных жидкостных масс.
Комплекс водоподготовки для промышленных сливов предприятий
Очистка щелочи углекислым газом
Второй по распространенности метод алкалиновой нейтрализации – насыщение раствора углекислотой – в жидком или газообразном состоянии.
Углекислотная установка водоочистки: основными элементами здесь являются бак-нейтрализатор и баллоны с CO2
В принципе, если взглянуть на этот подход более детально, то можно увидеть, что он также задействует технологию кислотного очищения: подающийся в сток углекислый газ, взаимодействуя с водой, «на лету» образует слабую угольную кислоту – именно она и нейтрализует щелочь.
Озонирование
В дополнение к двум вышеперечисленным методам стоит добавить озонирование – самый сложный и трудозатратный вариант нейтрализации щелочи. Чаще всего озонирование применяется для биологической ректификации воды и только там, где это действительно оправдано: уничтожение опасных микробов, бактерий, плесени, грибков, очищение стоков от нефтепродуктов, цианидов, ароматических углеводородов. Вдобавок, озонаторы имеют немалую стоимость, а ядовитость озона – I класс опасности – представляет опасность и для человека.
Индустриальные озонаторы
Ограниченно озонирование воды для достижения требуемого уровня pH применяется в рыбных хозяйствах (фермах), а также в больших аквариумах, океанариумах.
Кстати, трехатомный кислород (озон) в естественной среде существует всего от нескольких до нескольких десятков минут, после чего распадается на O2 с отрицательным изменением энтальпии ΔH (экзотермическая реакция).
Сводная таблица эффективности методов нейтрализации щелочи
| Способ | Плюсы | Особенности |
| Кислотный |
Рейтинг ☆☆☆☆☆ |
Требуется периодическое обслуживание системы. |
| Универсальность, высокая эффективность и производительность, низкая стоимость установок, компактность, простота размещения, мобильность, широкий выбор кислых реагентов для достижения максимальной эффективности очищения любых щелочных стоков. Низкие эксплуатационные траты. | ||
| CO2 |
Рейтинг ☆☆☆ |
Требуется дополнительное оборудование для хранения газообразной или твердой углекислоты. Относительно высокая сложность систем водоочистки. |
| Исключение возможности перенасыщения кислотой и смещения показателя pH в красную зону шкалы. | ||
| Озонирование |
Рейтинг ☆☆ |
Требуется тщательный контроль установок в силу высокой опасности озона. Реакции идут с большим выходом тепла, может потребоваться теплоотвод. |
| Высокая степень тонкой очистки, которая также включает в себя биологическое уничтожение вредных микроорганизмов. |
Заказ, покупка, доставка и монтаж установок щелочной нейтрализации
По любым вопросам, касающимся индивидуального проектирования, изготовления и недорогого приобретения современных и эффективных промышленных систем очистки стоков, пожалуйста, контактируйте с нашим заводом удобным Вам способом.
Осуществим быструю и аккуратную доставку оборудования по России, СНГ или странам Зарубежья. При необходимости проведем профессиональный монтаж или шефмонтаж «под ключ».
Полный комплект документации: схемы, чертежи, паспорта, сертификаты. Гарантия на станции и выполненные работы.
Вкусный способ увлажнения
Чтобы гидратировался лучше и дольше оставался гидратированным, добавьте в свой рацион немного электролитов! Наша электролитическая вода — простой и вкусный способ сделать это. Это похоже на приготовление собственного спортивного напитка — без добавления сахара.
Электролиты — это минералы в крови, такие как натрий и калий, которые помогают вашему организму регулировать уровень жидкости. 1 Напитки с большим количеством электролитов помогут вам оставаться гидратированным дольше, чем обычная вода.Цитрусовые, такие как лимоны и лаймы, содержат много электролитов. Как и кокосовая вода в нашем рецепте.
Ниже вы найдете один способ приготовления этого напитка, но вы можете изменить его любым способом по своему вкусу.
Если у вас заболевание почек или застойная сердечная недостаточность, посоветуйтесь с врачом, прежде чем делать этот напиток. Возможно, вам придется ограничить потребление жидкости.
Загрузите карту рецептов или пищевая ценность:
Настольный
Мобильный
Пищевая ценность
Электролит Вода
На две порции по 8 унций
Время на подготовку: 10 минут
Время приготовления: 5 минут
Инструменты для приготовления: Средняя чаша для смешивания, 2 стакана
Состав
- 1/4 чайной ложки соли
- 1/4 стакана лимонного сока
- 1/4 стакана сока лайма
- 1 столовая ложка меда или нектара агавы
- 1 1/2 стакана кокосовой воды
- 2 стакана холодной воды
Инструкции
- 1.Смешайте соль, лимонный сок, сок лайма и нектар агавы или мед в большой мерной чашке или миске.
- 2. Добавьте кокосовую воду и холодную водопроводную воду.
- 3. Налейте в два стакана со льдом.
Сделай сам
Есть много способов внести свой вклад в электролитную воду:
- Используйте пищевую соду вместо соли, если у вас высокое кровяное давление или вы соблюдаете диету с низким содержанием натрия.
- Используйте апельсины или грейпфрут вместо лимонов и лаймов для другого вкуса.
- Добавьте свежую мяту или имбирь для аромата.
- Для улучшения вкуса используйте газированную воду вместо водопроводной.
- Добавьте порошок электролита для перорального применения, чтобы получить больше электролитов.
Источник
- 1. WebMD
Сделайте простой домашний напиток с электролитом
Купленные в магазине напитки с электролитом в бутылках производятся из химически обработанных рафинированных сахаров, они содержат пищевые красители, а также искусственные ароматизаторы и другие менее привлекательные ингредиенты, такие как бромированные растительные масла.Это все ингредиенты, которые я предпочитаю не использовать на кухне, так зачем мне подавать кому-либо напиток, содержащий все вышеперечисленное?
Это правда, что пить воду очень важно, особенно если вы много тренируетесь и потеете. Многие эксперты сходятся во мнении, что большинство людей будет в порядке, просто выпив воду и соблюдая сбалансированную диету. И есть большая разница между спортсменами, которые тренируются каждый день по несколько часов подряд, и теми, кто тренируется по 20 минут перед завтраком.
Кому нужны электролиты?
Кэтлин Финли / Getty ImagesЭлектролиты включают кальций, натрий, магний, калий, хлорид и фосфат.По данным WebMD, это минералы, которые естественным образом встречаются в организме и могут влиять на pH-баланс жидкостей в вашем организме. В большинстве случаев ваше тело поддерживает все в равновесии, и простая вода — лучший ответ, но бывают моменты, когда домашний напиток может помочь.
Я слышал свидетельства других людей — одной из которых была беременная женщина, — которым в определенных ситуациях было трудно удержаться от обезвоживания одной водой. По совету врача моя беременная подруга начала делать домашний гидратационный напиток с натуральными электролитами, которые помогли им избежать обезвоживания.
Около пяти лет назад я неделю серьезно заболел и обнаружил, что у меня ужасное обезвоживание. Куриный бульон с большим количеством нерафинированной соли вернул меня в страну живых — по крайней мере, я так себя чувствовал. Электролиты в соли и курином бульоне, вероятно, заставили меня чувствовать себя намного лучше, когда вода для меня ничего не делала. Я также обнаружил, что чайный гриб помогает мне чувствовать себя более увлажненным, когда я болею или в жаркий день.
WebMD говорит, что, хотя при симптомах простуды или гриппа покупать спортивные напитки — это нормально, они согласны с тем, что купленные в магазине электролитные напитки содержат слишком много сахара.Вот тут-то и пригодится рецепт, представленный ниже.
Хотя большинству из нас не нужно беспокоиться об электролитах, если мы не потеем и не тренируемся более часа, по словам специалиста по детской спортивной медицине, бывают случаи — когда вы больны, беременны, кормите грудью или выходите на улицу. много на солнце — когда напиток, содержащий натуральные электролиты, может увлажнять. Если вы хотите заменить спортивные напитки по завышенной цене, их просто приготовить дома.
Как приготовить простой электролитный напиток в домашних условиях
lucagavagna / Getty ImagesИли вы можете сделать эту очень простую, легко адаптируемую версию, которая по вкусу напоминает апельсиновый лимонад с добавлением соли.Это вкусно и освежает. Я использовал местный сырой мед, который был нефильтрованным, поэтому он будет иметь слегка медовый вкус (даже с двумя столовыми ложками), но подойдет любой мед, который может быть у вас под рукой. Вы всегда можете заменить мед органическим небеленым сахаром, так как в некоторых рецептах он используется.
Супер простой напиток с электролитом
Состав:
- 1/2 стакана свежевыжатого апельсинового сока
- 1/4 стакана свежевыжатого лимонного сока
- 2 стакана фильтрованной воды
- 2-4 столовые ложки сырого меда по вкусу
- 1/8 чайной ложки нерафинированной соли (по вкусу)
В блендере смешайте все ингредиенты, пока мед или сахар не растворится.Попробуйте попробовать и при необходимости отрегулируйте. Наслаждаться.
Некоторые дополнительные естественные варианты включают простое употребление кокосовой воды. Баланс электролитов в кокосовой воде имитирует баланс электролитов в крови, а также освежает. Если хотите, можете добавить немного фруктового сока для придания аромата.
Вы также можете приготовить домашний сок в стиле «V8» с помощью соковыжималки, используя помидоры, сельдерей, морковь, немного петрушки, горсть зелени и даже лук, чеснок или красный перец. (Сельдерей содержит натуральный натрий и может сделать этот сок немного «солоноватым» на вкус, но некоторым людям нравится добавлять еще немного нерафинированной соли и молотого перца.) Другой вариант — простой овощной и фруктовый сок из 6 палочек сельдерея, 1 яблока и половины лимона.
Электролитная вода, польза для здоровья и как приготовить ее дома
От регулирования температуры тела, контроля артериального давления до улучшения настроения, памяти и продуктивности — поддержание гидратации — это основной шаг к сохранению здоровья. Говоря о питьевой воде, можно ли увеличить пользу от воды, добавив в нее электролиты? Читайте дальше, чтобы узнать больше о предвыборной воде и ее пользе для здоровья.Что такое электролиты?
Электролиты — это минералы, которые несут электрический заряд при растворении в воде. Наше тело сохраняет электролиты из пищи, которую мы едим, и жидкости, которую мы пьем. Минералы, несущие электрический заряд, включают калий, кальций и магний. Они распределяются по всему телу и используют свою электрическую энергию для облегчения важных функций организма. Некоторые из этих важных функций включают:
— Уравновешивание количества воды в вашем теле
— Уравновешивание уровня pH в организме
— Доставка питательных веществ в клетки
— Удаление отходов из ваших клеток
— Регулирование работы нервов, мышц, сердца и мозга
— Помощь в восстановлении поврежденных тканей
Часто спортивные напитки и вода насыщены электролитами.Это потому, что, когда вы тренируетесь и потеете, вы теряете ценное количество электролитов, которые необходимо восполнить. Поддержание достаточного количества электролита в организме важно не только для людей, занимающихся спортом, но и для всех. Электролиты нужны нам, чтобы ходить, дышать, смеяться и даже думать.
Что такое электролитная вода?
Электролитная вода, как следует из названия, — это вода, насыщенная электрически заряженными минералами, такими как натрий, калий, магний и кальций.Электролитная вода также называется минеральной и щелочной водой. Питьевая вода с электролитом улучшает гидратацию и другие функции организма. Вот еще больше преимуществ наличия воды с электролитом.
Повышает работоспособность
Во время тренировки вам необходимы дополнительные жидкости, чтобы восполнить потерю воды с потом. Даже 1-2-процентная потеря воды из тела может привести к снижению силы, скорости и сосредоточенности. Пот также содержит электролиты, включая натрий, небольшое количество калия, кальция и магния.
Таким образом, чтобы восполнить электролиты, потерянные с потом, вы должны пить воду с электролитами вместе с обычной водой во время тренировки. Это помогает улучшить работу вашего сердца, мозга, мышц и нервной системы.
Предотвращает тепловой удар
От легкой тепловой сыпи до тяжелого опасного для жизни теплового удара жаркая погода может поставить под угрозу ваше здоровье. Ваше тело справляется с этим, выделяя тепло через кожу и потоотделение. Но эта естественная система охлаждения может выйти из строя в слишком жаркую погоду, что приведет к опасному повышению температуры тела.
Лучший способ предотвратить заболевания, связанные с жарой, — это ограничить время пребывания на жаре и получать много жидкости и электролитов.
Напитки, содержащие кофеин, могут ухудшить состояние, вызывая обезвоживание, поэтому их нельзя употреблять в жаркую погоду.
Регидрат во время болезни
Такие проблемы, как диарея и рвота, если они сохраняются в течение длительного времени, могут привести к обезвоживанию, если жидкости и электролиты не будут заменены. В таком состоянии врачи рекомендуют пить воду с электролитами, чтобы предотвратить обезвоживание.
В некоторых случаях напитков с электролитом может быть недостаточно для лечения тяжелого обезвоживания. Если вы чувствуете себя плохо в течение более 24 часов и не можете поддерживать уровень жидкости, вам следует обратиться к врачу.
Поддерживает работу нервной системы
Даже небольшое снижение гидратации тела может привести к снижению когнитивных способностей, снижению концентрации, внимательности и временами замедлению реакции. При 3-процентном обезвоживании тела ваша реакция становится равной времени реакции человека с нулевым содержанием алкоголя в крови.08 процентов.
Наша нервная система — это совокупность нервов и специализированных клеток, которые передают сигналы от вашего мозга к другим частям тела.
Натрий — Инициирует электрические импульсы, необходимые нервным клеткам для правильной коммуникации.
Калий — Нейтрализует нервную клетку, чтобы она могла повторно инициировать последующие электрические импульсы
Магний — обеспечивает эффективную передачу электрических импульсов
Как сделать электролитную воду в домашних условиях
Чтобы приготовить один стакан (250 мл) электролитной воды, вам понадобится 1/4 чайной ложки соли, 1/4 стакана лимонного сока, 1.5 стаканов несладкой кокосовой воды, 2 стакана холодной воды.
Поместите все ингредиенты в большой стакан, хорошо перемешайте и охладите. Вы также можете смешать чайную ложку меда, чтобы усилить вкус.
Преимущества щелочной воды — Преимущества электролитной воды
Предоставлено: MoviestoreShutterstock
.- Существует много шума вокруг так называемой улучшенной воды, такой как вода с активированным углем и щелочная вода, которые утверждают, что предлагают множество преимуществ для здоровья
- Нет никаких доказательств того, что улучшенная вода лучше для вас, чем обычная вода
- Есть Однако есть некоторые свидетельства того, что кокосовая вода содержит достаточно калия для поддержания гидратации.
Сохранение гидратации чрезвычайно важно для вашего здоровья, особенно когда вы регулярно проливаете пот в тренажерном зале.(Неудивительно, что Том Брэди, как сообщается, выпивает 25 стаканов воды в день.) Как мы уже сообщали, даже если вы немного обезвожены, ваша аэробная производительность начинает ухудшаться, и вы можете снизить мышечную выносливость. власть и сила. Да, пора восполнить водный баланс.
Введите новый урожай «улучшенных вод», которые утверждают, что предлагают больше пользы для здоровья и увлажняют вас больше, чем простой старый h3O. Эти суперводы с повышенным содержанием электролитов и витаминов могут звучать великолепно на поверхности, но когда вы копаете воду немного глубже, наука становится немного туманной.
По мнению экспертов, самый усовершенствованный h3O просто не соответствует ожиданиям. «Лучше сэкономить деньги и придерживаться водопроводной воды», — говорит Алисса Рамси Р.Д., C.S.C.S., эксперт по повышению спортивных результатов.
Что такое улучшенные воды?
Getty Images
Обогащенная вода на самом деле является широким общим термином для широкого спектра продуктов, от воды, насыщенной витаминами, до продуктов, которые, как утверждается, содержат дополнительные электролиты, такие как калий, которые, как говорят, помогают вашему организму быстрее усваивать больше воды.
Недавно мы также увидели такие продукты, как щелочная вода, которая, как говорят, нейтрализует кислоты в кровотоке, помогая организму более эффективно усваивать питательные вещества. Поскольку щелочная вода имеет более высокий уровень pH, чем обычная водопроводная вода, «ее сторонники утверждают, что она может нейтрализовать кислоту в вашем кровотоке и лучше для вас, чем обычная вода», — объясняет Рамси. (Это та же теория, что и щелочная диета, которая, как утверждается, для повышения вашей энергии и ускорения похудания.)
Но, как и о щелочной диете, нет надежных данных, подтверждающих преимущества щелочной воды.«Наше тело отлично справляется с поддержанием pH в очень узком диапазоне», — говорит Рамси. «Питьевая щелочная вода на это не повлияет».
Также много шума вокруг воды, наполненной древесным углем: эксперты по здоровью утверждают, что активированный уголь может выводить токсины из вашего тела при регидратации, тем самым повышая вашу энергию и просто улучшая общее самочувствие. Но «идея о том, что активированный уголь очистит ваше тело от токсинов, не имеет смысла», — объясняет Рамси. Это потому, что активированный уголь в основном используется для лечения случаев отравления, связываясь с определенными веществами в желудке и тонком кишечнике, «не с какими-либо». токсины, накопившиеся в вашем теле », — говорит она.Это то, что ваша печень делает сама.
Вода, насыщенная витаминами, также не обязательно лучше для вас, чем простой старый h3O. «Если вы придерживаетесь разнообразной сбалансированной диеты, вы, вероятно, удовлетворяете свои потребности в витаминах», — говорит Рамси. Многие обогащенные витаминами воды также содержат добавленный сахар и калории, которые могут быстро накапливаться, поэтому вы всегда должны «искать витамины в первую очередь из пищи», — говорит Крис Соллид, старший директор по связям с питанием в Фонде Международного совета по продовольственной информации (IFICF). ).
Есть ли причина пить усиленную воду?
Getty Images
Есть одна вода с улучшенным содержанием воды, которая действительно может помочь вам улучшить гидратацию: вода с повышенным содержанием электролитов, например, кокосовая вода. «Кокосовая вода содержит калий, электролит, который теряется, когда вы сильно потеете во время тяжелой тренировки или тренировки при высоких температурах», — объясняет Рамси.
Но это относится только к самым сложным тренировкам.«Если вы весь день сидите за своим столом, питьевая вода с электролитами не поможет вам улучшить гидратацию», — говорит Соллид.
Как лучше всего избежать обезвоживания?
Этот контент импортирован из Giphy. Вы можете найти тот же контент в другом формате или найти дополнительную информацию на их веб-сайте.
Вместо того, чтобы добавлять в воду кучу добавок, лучший способ избежать обезвоживания — это довольно просто: пить.
«Самое важное, что вы можете сделать, чтобы получить пользу от воды для здоровья, — это пить ее каждый день в достаточном количестве», — говорит Алисса Ардолино, Р.Н., Диетолог IFICF.
Хотя общепринятая мудрость гласит, что вам следует выпивать восемь стаканов воды по 8 унций в день, количество зависит от того, в каком климате вы живете, и от того, ведете ли вы активный образ жизни. Если вы проводите в тренажерном зале более полутора часов в день, лучший способ избежать обезвоживания — это выпивать около 17 унций воды (или двух стандартных стаканов) перед тренировкой, а также 7-10 унций воды. каждые полчаса во время тренировки. По словам Ардолино, после тренировки вы должны выпить восемь унций в течение 30 минут после восстановления.
Для обычного парня «лучший способ узнать, есть ли у вас водный баланс, — это обратить внимание на то, как часто вы ходите в туалет, и на цвет вашей мочи», — говорит Рамси. Чтобы оставаться в зоне здорового увлажнения, ваша моча должна быть цвета лимонада.
Итог: улучшенная вода на самом деле не полезнее для здоровья. Лучший способ восполнить водный баланс — придерживаться старого доброго h3O. Но если вы действительно предпочитаете вкус «улучшенной» воды, проверьте этикетку и следите за количеством сахара.«Если напиток в остальном идентичен обычной воде, но содержит еще несколько витаминов, вам решать, хотите ли вы потратить дополнительные деньги», — говорит Рамси.
Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Как сделать щелочную воду дома и какие преимущества это дает PureWow
Вода действительно полезна, никто с этим не спорит.Но разве одни воды лучше для вас, чем другие? Зависит от того, кого вы спросите. В то время как многие люди довольны тем, что употребляют простой старый h3O, есть надежное сообщество людей, которые доверяют функциональным водам — в основном, старому доброму h3O с добавлением специальных ингредиентов (таких как травы, витамины и антиоксиданты), которые утверждают, что приносят пользу для здоровья.
Щелочная вода — одна из самых известных функциональных вод.Вот небольшой урок науки: каждая еда и питье имеют уровень pH от 0 (очень кислая) до 14 (очень щелочная или щелочная). Нормальная питьевая вода, в свою очередь, обычно имеет pH 7. Щелочная вода обычно имеет pH от 7,5 до 9. Сторонники употребления в пищу и питье более щелочных продуктов считают, что это поможет поддерживать уровень pH в крови как можно более щелочным. В свою очередь, считается, что наличие большего количества щелочей снижает риск развития ряда заболеваний, включая рак и артрит, а также повышает уровень энергии, уменьшает воспаление и приносит множество других преимуществ для здоровья.Щелочная вода может поступать из источников или артезианских колодцев в районах с большим количеством растворенных минералов, но вы также можете приготовить ее самостоятельно.
Верите вы в эту шумиху или нет, пить больше воды никогда не бывает плохо. Если вы хотите попробовать всю технологию щелочной воды, есть способы сделать ее самостоятельно, вместо того, чтобы тратить деньги на пластиковые бутылки с этой штукой.Вот четыре популярных метода.
1. Купите ионизатор воды
К сожалению, для вашего кошелька, один из самых эффективных способов приготовления щелочной воды в домашних условиях также является самым дорогим. Этот ионизатор от Aqua-Ionizer Pro, например, находится на нижнем уровне почти в 500 долларов. Ионизаторы воды работают как электролизеры воды. Не вдаваясь в подробности, эти дети создают электрохимический процесс, который работает, разделяя отрицательный и положительный электроды в воде.Машина возвращает два потока воды: щелочную в одном потоке и кислую — в другом. Ионизатор очень эффективен при производстве основной воды. Глазурь на торте заключается в том, что он делает это без добавления каких-либо веществ. Если вы очень любите пить щелочную воду, ионизаторы — это экономичная альтернатива покупке ящиков с щелочной водой в долгосрочной перспективе. Они также уменьшают потребность в пластиковых бутылках, поэтому они более безопасны для окружающей среды.
2.Используйте пищевую соду
Это не только для печенья и пирожных, ребята. Пищевая сода с уровнем pH 9 является одним из самых популярных и простых способов подщелачивания питьевой воды. (Вероятно, он уже есть у вас на кухне.) Чтобы попробовать, смешайте ⅛ столовой ложки пищевой соды с 8 унциями очищенной воды. Вам нужно будет тщательно перемешать или встряхнуть смесь, чтобы пищевая сода полностью растворилась, прежде чем вы ее выпьете. При выборе этого варианта следует иметь в виду, что пищевая сода содержит довольно много натрия.Итак, если вы следите за потреблением соли, вы можете попробовать один из других методов из этого списка.
3. Попробуйте капли pH
Хотя у пищевой соды есть множество других применений, снижение pH (например, от HealthyWiser) специально разработано для превращения обычной питьевой воды в щелочную. Эти жидкие капли состоят из высококонцентрированных минералов и электролитов, поэтому вам нужно всего лишь добавить пару капель в каждый стакан воды, чтобы повысить ее pH.Жидкости обычно продаются в небольших удобных бутылочках, поэтому их можно везде носить с собой. Любители понижения pH добавляют их не только в воду, но и в кислые напитки — кхм, кофе — для снижения кислотности. Да, они безвкусные. Это еще один доступный вариант: поскольку вам нужно всего несколько капель на стакан воды, одной бутылки за 15–20 долларов хватит надолго.
4.Купить кувшин для ионизирующей воды
Эти фильтры похожи на электрические ионизаторы, но более транспортабельны и доступны по цене. (Например, этот от Invigorated Water стоит всего 40 долларов.) Чтобы использовать его, вы просто наливаете воду в фильтр и даете ему постоять около пяти минут. Кувшины с щелочными фильтрами выполняют две функции: во-первых, вода фильтруется, чтобы уменьшить содержание хлора и других токсинов, которые могут присутствовать. Во-вторых, щелочной кувшин добавит в воду щелочные минеральные гидраты. Думайте об этом как о обычном фильтре Brita с парой дополнительных шагов и потенциальными преимуществами.
По словам зарегистрированного диетолога Мэриэнн Уолш, «обычно неплохо принимать любую функциональную воду, способствующую« детоксикации », с недоверием к ней». ВНИМАНИЕ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! Если это поможет вам выпить больше h3O, сделайте это, но не ждите никаких чудес. «Если у вас здоровые печень и почки, значит, ваше тело отлично справляется с детоксикацией», — сказал нам Уолш. В общем, функциональные воды не причинят вреда вашему организму.Но они не обязательно превратят вас в сияющую версию Гвинет Пэлтроу. Эй, если какой-то дополнительный аромат или добавленные ингредиенты помогут вам выпить больше прозрачного напитка, тогда непременно попробуйте — только не ждите никаких чудес.
Возможные преимущества щелочной воды
Некоторые люди считают, что чем более щелочной является организм, тем меньше вероятность заражения определенными болезнями и болезнями.Одно исследование, проведенное в 2016 году итальянским университетом Падуи, показало, что мыши, потреблявшие щелочную воду, жили дольше, чем мыши, которые этого не делали, хотя исследователи признали, что необходимы дополнительные исследования. Другое исследование, опубликованное в журнале The Annals of Otology, Rhinology и Laryngology , показало, что употребление природно газированной щелочной воды из артезианской скважины с pH 8,8 может помочь дезактивировать пепсин, фермент, вызывающий кислотный рефлюкс.
Потенциальные риски щелочной воды
Хотя употребление щелочной воды может не вызвать никаких проблем со здоровьем, многие эксперты, такие как диетолог Дженнифер Блоу, говорят, что это не более чем псевдонаучная причуда.«Щелочная вода, которая утверждает, что меняет уровень pH в организме, является, к сожалению, одной из тенденций, которая прижилась — жестко», — сказал нам Блоу. «Но пусть вас не обманывает этот волшебный эликсир. Нет никаких достоверных научных доказательств, подтверждающих это утверждение, и нет особой пользы для балансирования уровней pH в вашем организме, поскольку ваше тело будет делать это само ». Мелисса Келли, MS, RD, CDN, вообще скептически относится к щелочной диете. «В целом, организм жестко регулирует уровень pH в крови, и невозможно повлиять на него с помощью диеты», — сказала она нам.«В то время как щелочная диета поощряет фрукты и овощи с помощью растительной диеты и ограничивает продукты с высокой степенью обработки, исследования отсутствуют».
СВЯЗАННЫЙ : Как пить больше воды в течение дня
Что такое электролитная вода и каковы ее преимущества?
Все мы знаем, что питьевая вода полезна для вашего здоровья, от регулирования температуры тела и артериального давления до улучшения вашего настроения, памяти и продуктивности, преимущества питьевой воды поистине замечательны. 1 .Но усиливается ли польза от питья h3O за счет добавления в воду электролитов? Эксперты по Quench Water расскажут, как электролиты могут усилить вашу гидратацию.
Что такое электролиты?
Электролиты — это минералы, которые несут электрический заряд при растворении в воде. Ваше тело сохраняет электролиты из пищи, которую вы едите, и жидкости, которую вы пьете. Эти минералы, такие как натрий, калий, кальций и магний, распределяются по вашему телу и используют свою электрическую энергию для облегчения важных функций организма, в том числе: 2
- Сбалансируйте количество воды в теле
- Сбалансируйте уровень pH вашего тела
- Переносите питательные вещества в клетки
- Уберите отходы из своих камер
- Регулируйте функции нервов, мышц, сердца и мозга
- Помогает восстановить поврежденные ткани 3
Часто спортивные напитки и вода, насыщенная электролитами, будут ссылаться (или нацеливаться) на спортсменов в их маркетинге.Это потому, что, когда человек тренируется и потеет, он теряет ценные электролиты, которые необходимо освежить. Хороший баланс электролитов важен не только для тех, кто занимается спортом. Нам нужны электролиты в нашем организме, чтобы делать все: ходить, дышать, даже думать! Без электролитов в нашем мозгу нервные клетки не очень хорошо взаимодействуют.
Что такое вода с электролитом?
Вода с электролитом насыщена электрически заряженными минералами, такими как натрий, калий, кальций и магний.Иногда электролитную воду называют минеральной или щелочной водой. Вы не поверите, но морская вода и водопроводная вода даже содержат электролиты в виде разного рода соли. Очевидно, пить соленую воду не рекомендуется; правильный баланс минералов жизненно важен для укрепления здоровья. Питьевая вода с электролитом специально разработана для улучшения гидратации и других функций организма за счет оптимальной концентрации только самых полезных электролитов. Электролитные воды, как и спортивные напитки, содержат электролиты для большей гидратации, но спортивные напитки часто содержат большое количество сахара и калорий.
Каковы преимущества электролитной воды?
Вода составляет до 60 процентов тела взрослого человека. Когда вы теряете даже небольшую часть этих 60 процентов, ваше тело не может выполнять все свои основные функции. 4 Когда вы обезвоживаетесь, в дело вступают электролиты, регулирующие уровень гидратации. 5
В некоторых случаях уровень электролитов в крови может стать слишком низким, вызывая дисбаланс. Нарушение баланса электролитов может пагубно сказаться на вашем здоровье.Симптомы могут включать: 6
- Усталость
- Быстрое или нерегулярное сердцебиение
- Онемение и покалывание
- Путаница
- Слабость и спазмы мышц
- Головные боли
- Судороги
Дисбаланс электролитов часто возникает из-за обезвоживания. Таким образом, важно избегать обезвоживания в течение дня, особенно во время упражнений, болезней или чрезмерной жары, когда вы теряете больше всего жидкости. 7 Хотя обычная питьевая вода является обязательным условием для предотвращения обезвоживания, лучше заменить потерянные жидкости электролитной водой, и вот почему:
1. Улучшение выполнения упражнений
Во время физической активности вам необходимы дополнительные жидкости, чтобы восполнить потерю воды с потом. Фактически, потеря воды всего на 1-2% от веса вашего тела может привести к снижению силы, скорости и концентрации. Пот также содержит электролиты, в том числе значительное количество натрия, а также небольшое количество калия, кальция и магния. 8
Для восполнения электролитов, теряемых с потом, рекомендуется пить воду с повышенным содержанием электролитов вместо обычной питьевой воды во время тренировки. Это поможет улучшить работу вашего сердца, мозга, мышц и нервной системы. 9
2. Поддержка функции нервной системы
Мы все можем представить себе спортсменов, пьющих спортивные напитки, чтобы восполнить потерянные электролиты, но не только спортсмены нуждаются в поддержании водного баланса и баланса жидкости в организме.Понимание важности постоянного увлажнения помогает нам оставаться в безопасности и, в конечном итоге, более продуктивными. Даже небольшое снижение гидратации может привести к снижению когнитивных способностей, снижению концентрации и внимания, а также замедлению реакции. При обезвоживании 3% время реакции эквивалентно времени реакции человека с содержанием алкоголя 0,08%. 10
Ваша нервная система представляет собой сложную совокупность нервов и специализированных клеток, которые передают сигналы от вашего мозга к другим частям вашего тела.Электролиты играют неотъемлемую роль в этом процессе коммуникации.
- Натрий — инициирует электрические импульсы, необходимые нервным клеткам для правильной связи.
- Калий — нейтрализует нервную клетку, чтобы она могла повторно инициировать последующие электрические импульсы
- Магний — обеспечивает эффективную передачу электрических импульсов
Ваш рацион должен включать достаточное количество источников натрия, калия и магния, чтобы соответствовать рекомендуемой суточной дозе, чтобы поддерживать непрерывную работу мозга.Самый простой способ достичь своей ежедневной цели — пить воду с повышенным содержанием электролитов. 11
3. Регидратация во время болезни
В краткосрочной перспективе рвота и диарея обычно не являются серьезными заболеваниями. Однако тяжелые или постоянные симптомы могут быстро привести к обезвоживанию, если жидкости и электролиты не заменены. Врачи рекомендуют пить воду с повышенным содержанием электролитов при первых признаках болезни, чтобы предотвратить обезвоживание. Спортивные напитки похожи, но содержат большее количество сахара.Их не рекомендуют, так как сахар может усугубить болезнь. Тем не менее, спортивные напитки можно переносить, если их разбавить 1 частью воды или 1 частью спортивного напитка. 12
Важно отметить, что напитков с электролитом может быть недостаточно для лечения тяжелого обезвоживания. Если болезнь длится более 24 часов или если вы не можете удерживать жидкость, обратитесь за медицинской помощью.
4. Предотвращение теплового удара
Жаркая среда подвергает вас риску различных заболеваний, связанных с жарой, от легкой тепловой сыпи до опасного для жизни теплового удара.Обычно ваше тело управляет теплом, выделяя его через кожу и потоотделение. Однако в жаркую погоду эта система охлаждения может перестать работать, в результате чего температура вашего тела может подняться до опасно высокого уровня. 13 Ключом к профилактике заболеваний, связанных с жарой, является ограничение времени нахождения в жаре. Однако получение большого количества жидкости и электролитов также чрезвычайно важно, чтобы помочь вашему телу оставаться прохладным. 14
В жарких условиях вода с повышенным содержанием электролитов рекомендуется для гидратации по сравнению с другими напитками из-за ее способности восполнять жизненно важные электролиты, теряемые с потом.Напитки, содержащие сахар и кофеин, такие как газированные напитки, кофе и чай, могут усугубить обезвоживание, равно как и алкоголь. 15
Приобретите quenchWATER + с улучшенными электролитами, чтобы почувствовать разницу на рабочем месте
quenchWATER + — это наша щелочная вода с минеральными добавками и электролитами под маркой Quench, поставляемая к вам через безбутылочные водоохладители Quench. Мы производим quenchWATER + с использованием современной технологии фильтрации. Наша запатентованная установка с 5 фильтрами производит чистейшую воду с помощью обратного осмоса (RO), затем вода проходит через сжатые минералы в нашем фильтре Mineral +, чтобы добавить смесь натрия, калия, кальция, магния и других полезных минералов для создания потрясающего вкуса. вода с повышенным содержанием электролита.
Итак, есть ли у вас сотрудники, работающие на горячем складе, участники, тренирующиеся в тренажерном зале, пациенты, выздоравливающие в больнице, или что-то еще — Quench обеспечит ваши оптимальные потребности в гидратации с помощью нашей улучшенной электролитом QuenchWATER +. А с нашими охладителями для воды без бутылок вам больше не придется беспокоиться о запасах, хранении и заказе 5-галлонных пластиковых кувшинов для воды или одноразовых пластиковых бутылок. Это беспроигрышный вариант; гидратируйте своих сотрудников, сохраняя при этом окружающую среду!
Чтобы узнать больше о quenchWATER + и выбрать кулер для воды, посетите наш веб-сайт.
1 https://www.cdc.gov/healthywater/drinking/nutrition/index.html
2 https://medlineplus.gov/fluidandelectrolytebalance.html
3 https://medlineplus.gov/ ency / article / 002350.htm
4 https://www.usgs.gov/special-topic/water-science-school/science/water-you-water-and-human-body?qt-science_center_objects=0 # qt-science_center_objects
5 https://www.livestrong.com/article/521215-the-benefits-of-electrolytes-in-water/
6 https: // www.medicalnewstoday.com/articles/153188
7 https://www.ncbi.nlm.nih.gov/pubmed/17277604
8 https://www.ncbi.nlm.nih.gov/pubmed/27939861
9 https://www.ncbi.nlm.nih.gov/pubmed/28332116
10 http://www.resourceoptions.com/how-electrolytes-can-boost-productivity
11 https: / /healthyeating.sfgate.com/electrolytes-brain-2895.html
12 https://www.ncbi.nlm.nih.gov/pubmed/8604285
13 https: // www.ncbi.nlm.nih.gov/pubmed/15952443
14 https://www.cdc.gov/disasters/extremeheat/faq.html
15 https://www.cdc.gov/features/prevent- тепловая болезнь / index.html
советов по гидратации, которые необходимо знать всем студентам горячей йоги
Мы знаем, что питьевая вода — это здоровый образ жизни. Но это еще более важно, если вы практикуете горячую йогу, как это делаем мы в Alkaline Wellness.
Мы на 80% состоят из воды, поэтому регулярное увлажнение необходимо для оптимального здоровья.
Рекламируется множество напитков, которые помогают утолить жажду, в том числе различные газированные напитки, ароматизированная вода и спортивные напитки. Но что обеспечивает лучшее увлажнение?
Сегодня я хочу поговорить о важности гидратации и о том, почему вам это нужно.
Гидратация и электролиты
Пьете ли вы воду из-под крана или фильтрованную воду, в любой воде есть электролиты. Электролиты включают калий, натрий, магний и кальций.
Электролиты — это минералы, которые при растворении в воде проводят электричество.Обычно они распределяются в организме в виде жидкости. Они обнаруживаются в крови, моче, тканях и других жидкостях организма.
Чтобы наши мышцы сокращались, нам необходимо достаточное количество натрия и калия, чтобы получить достаточно энергии, чтобы наши мышцы могли сокращаться.
Электролиты необходимы для:
- Баланс жидкости
- Регулировка артериального давления
- Сокращение мышц, включая сердце
- Поддержание правильной кислотности крови
- Нервы для передачи информации телу
- Удаление отходов из организма и клеток
- Перемещение питательных веществ в клетки
Электролиты находятся в пище, которую вы едите, а также в жидкостях, которые вы пьете.
Увлажнение для горячей йоги
Занимаясь горячей йогой, мы можем потерять значительное количество электролитов из-за потоотделения.
Итак, при подготовке к занятию важно убедиться, что вы не только увлажняете воду, но и получаете достаточное количество электролитов, чтобы вы могли безопасно заниматься.
Баланс электролитов является ключевым. Для тех, кто практикует горячую йогу, если не гидратироваться должным образом, вы рискуете развить симптомы обезвоживания, такие как обморок, упадок сил, слабость, головные боли, онемение, покалывание и спазмы.
Увлажнение перед занятием — это ключ к подготовке к занятию, а увлажнение после занятия необходимо для восполнения потерянных электролитов.
Я лично тренировался много месяцев без пополнения запасов электролитов, и после занятий я испытал сильные головные боли и усталость.
Источники электролитов
Есть много спортивных напитков, таких как Gatorade, которые утверждают, что содержат электролиты. Однако они содержат сироп с высоким содержанием фруктозы, химические вещества и искусственные красители, что делает эти напитки не самыми полезными для здоровья.
Кокосовая вода — это здорово, но я обнаружил, что в ней недостаточно электролитов для того количества потоотделения, которое бывает в горячей йоге. Но поскольку кокосовая вода — это природная вода, и мне нравится ее вкус, я либо добавляю кокосовую воду, добавляя таблетку или порошок электролита, либо принимаю эти добавки после питья кокосовой воды.
Когда мы правильно гидратированы с помощью необходимых электролитов, вы можете ожидать более сильной практики йоги и большего опыта.Уровень энергии после занятий значительно улучшится по сравнению с отсутствием добавок электролитов.
Мои рекомендации по электролитам:
- Таблетки электролита NUUN — вы можете приобрести в любом магазине товаров для здоровья.
- Emergen C — порошок электролита с добавлением витамина C.
- Endura от Metagenics — это моя любимая добавка к электролиту, которую мы продаем в нашем центре.





 Для работы вспышек и экранов, для воспроизведения глубоких басов, современные устройства используют очень сильный ток. Созданные по старым технологиям батарейки не выдерживают никакой критики при работе с большими уровнями токов. Хотя новейшие гальванические элементы и функционируют по давно известным принципам (разработанным еще сто лет назад), благодаря новым технологиям и материалам они обеспечивают все потребности современных устройств.
Для работы вспышек и экранов, для воспроизведения глубоких басов, современные устройства используют очень сильный ток. Созданные по старым технологиям батарейки не выдерживают никакой критики при работе с большими уровнями токов. Хотя новейшие гальванические элементы и функционируют по давно известным принципам (разработанным еще сто лет назад), благодаря новым технологиям и материалам они обеспечивают все потребности современных устройств.
